Trắc nghiệm Hóa học 12 Kết nối bài 16: Điện phân
Bộ câu hỏi và Trắc nghiệm Hóa học 12 Kết nối tri thức bài 16: Điện phân có đáp án. Học sinh luyện tập bằng cách chọn đáp án của mình trong từng câu hỏi. Dưới cùng của bài trắc nghiệm, có phần xem kết quả để so sánh kết quả bài làm của mình. Kéo xuống dưới để bắt đầu.
TRẮC NGHIỆM
Câu 1: Điện phân một dung dịch gồm a mol FeSO4 và b mol KCl. Nếu b > 2a mà ở cathode chưa có khí thoát ra thì dung dịch sau điện phân chứa
- A. K+, SO42-, Cl-.
- B. K+, SO42-, Fe2+.
- C. K+, Cl-.
D. K+, SO42-, Fe2+, Cl -.
Câu 2: Tại anot xảy ra quá trình gì?
A. oxi hóa (quá trình nhường e)
- B. khử (quá trình nhường e)
- C. oxi hóa (quá trình nhận e)
- D. khử (quá trình nhận e)
Câu 3: Điều chế K bằng cách điện phân nóng chảy KCl. Tạo catot xảy ra quá trình nào?
- A. 2Cl- → Cl2 + 2e
- B. K + + 2e → K
C. K + + e → K
- D. K + - e → K
Câu 4: Để điều chế kim loại nhóm IIA, ta có thể sử dụng phương pháp nào?
- A. điện phân nóng chảy muối cácbon nát
- B. đun nóng muối cácbon nát
- C. đun nóng muối clorua
D. điện phân nóng chảy muối clorua
Câu 5: Để điều chế kim loại trung bình yếu, ta dùng phương pháp nào?
- A. dùng kim loại khác mạnh hơn đẩy kim loại yếu hơn trong hợp chất của chúng
B. điện phân dung dịch muối của chúng
- C. nung nóng các hợp chất của chúng
- D. điện phân nóng chảy hidroxit.
Câu 6: Hãy viết phương trình điều chế kim loại Ag?
- A. AgNO3 + H2O
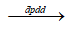 2Ag + ½ O2 + 2HNO3
2Ag + ½ O2 + 2HNO3 - B. 2AgNO3 + H2O
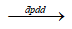 Ag + ½ O2 + HNO3
Ag + ½ O2 + HNO3 C. 2AgNO3 + H2O C. 2AgNO3 + H2O
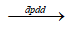 2Ag + ½ O2 + 2HNO3 2Ag + ½ O2 + 2HNO3
2Ag + ½ O2 + 2HNO3 2Ag + ½ O2 + 2HNO3- D. 2AgNO3 + 2H2O
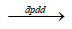 2Ag + ½ O2 + HNO3
2Ag + ½ O2 + HNO3
Câu 7: Khi điện phân dung dich, khối lượng dung dịch giảm được xác định như thế nào?
A. Bằng mkim loại + mkhí thoát ra
- B. Bằng mkim loại
- C. Bằng mkhí thoát ra
- D. Bằng khối lượng nước thoát ra
Câu 8: Khi điện phân dung dịch hỗn hợp Cu(NO3)2; AgNO3, điều khẳng định nào sau đây là đúng?
A. Tại anode xảy ra quá trình oxi hóa H2O.
- B. Ngay từ đầu đã có khí thoát ra tại cathode.
- C. Khối lượng dung dịch giảm là khối lượng của kim loại thoát ra bám vào cathode.
- D. Tại cathode xảy ra quá trình khử Cu2+ trước.
Câu 9: Tiến hành điện phân dung dịch chứa CuSO4 và NaCl bằng điện cực trơ màng ngăn xốp đến khi khí bắt đầu thoát ra ở cả 2 điện cực thì ngừng. Dung dịch sau điện phân hòa tan được Al2O3. Nhận định nào sau đây đúng:
- A. Ở cathode có khí H2 thoát ra
- B. H2O tham gia phản ứng điện phân ở cathode
- C. Khí thoát ra ở anode chỉ có Cl2.
D. Khí thoát ra ở anode là Cl2 và O2.
Câu 10: Tiến hành điện phân dung dịch NaCl bằng điện cực trơ, thu được một khí X duy nhất. Điều khẳng định nào sau đây là đúng?
- A. X là khí oxygen.
B. X là khí hydrogen.
- C. X là khí chlorine.
- D. Có dùng màng ngăn xốp.
Câu 11: Khi điện phân dung dịch X với điện cực trơ thì pH của dung dịch tăng. Dung dịch X là
- A. dung dịch Na2SO4.
- B. dung dịch H2SO4
C. dung dịch HCl.
- D. dung dịch CuSO4
Câu 12: Dung dịch X chứa hỗn hợp các muối: NaCl, CuCl2, FeCl3 và ZnCl2. Kim loại cuối cùng thoát ra ở cathode khi điện phân dung dịch X là
- A. Fe.
B. Zn.
- C. Na.
- D. Cu.
Câu 13: Điện phân dung dịch hỗn hợp AgNO3, Cu(NO3)2, Fe(NO3)3. Các chất lần lượt xuất hiện tại cathode theo thứ tự
A. Ag - Cu - Fe.
- B. Cu - Ag - Fe.
- C. Ag - Cu - H2.
- D. H2 - Cu - Ag.
Câu 14: Khi điện phân dung dịch (có màng ngăn) gồm NaCl, HCl, CuCl2 và quỳ tím. Màu của dung dịch biến đổi ra sao khi điện phân đến khi hết NaCl?
- A. Tím → xanh → đỏ.
- B. Tím → đỏ → xanh.
- C. Xanh → đỏ → tím.
D. Đỏ → tím → xanh.
Câu 15: Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại điều chế được bằng phương pháp điện phân dung dịch (điện cực trơ) là
- A. 1.
- B. 4.
C. 2.
- D. 3.
Xem toàn bộ: Giải Hóa học 12 Kết nối bài 16: Điện phân
Nội dung quan tâm khác
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận