Đáp án Hoá học 12 kết nối Bài 16: Điện phân
Đáp án Bài 16: Điện phân. Bài giải được trình bày ngắn gọn, chính xác giúp các em học Hóa học 12 Kết nối dễ dàng. Từ đó, hiểu bài và vận dụng vào các bài tập khác. Đáp án chuẩn chỉnh, rõ ý, dễ tiếp thu. Kéo xuống dưới để xem chi tiết
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 16. ĐIỆN PHÂN
MỞ ĐẦU
Trong pin điện hóa, hóa năng được chuyển thành điện năng của dòng điện một chiều thông qua phản ứng oxi hóa – khử tự xảy ra. Ngược lại, trong bình điện phân, điện năng của dòng điện một chiều được sử dụng để thực hiện phản ứng oxi hóa – khử không tự xảy ra. Vậy quá trình điện phân tuân theo nguyên tắc nào và có ứng dụng gì trong sản xuất?
Đáp án chuẩn:
+ Tại anode, chất khử mạnh hơn bị oxi hoá trước.
+ Tại cathode, chất ion hoá mạnh hơn bị khử trước.
- Ứng dụng: sản xuất kim loại, tinh chế kim loại và mạ điện.
 I. HIỆN TƯỢNG ĐIỆN PHÂN
I. HIỆN TƯỢNG ĐIỆN PHÂN
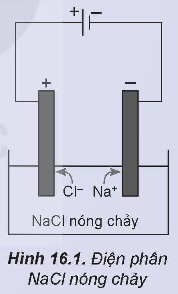
Hoạt động nghiên cứu: Quá trình điện phân NaCl nóng chảy được tiến hành theo hai bước như sau:
Bước 1: Nung NaCl trong bình đến nóng chảy, thu được chất lỏng có khả năng dẫn điện.
Bước 2: Nhúng hai điện cực than chì vào bình đựng NaCl nóng chảy rồi nối chúng với hai cực của nguồn điện một chiều (khoảng 7 V). Các ion di chuyển về các điện cực trái dấu, ở điện cực dương có khí Cl2 thoát ra và ở điện cực âm, Na được tạo thành.
Thực hiện các yêu cầu sau:
1. Viết phương trình phân li của NaCl ở bước 1.
2. Viết quá trình xảy ra ở mỗi điện cực.
3. Viết phương trình hóa học của phản ứng xảy ra trong quá trình điện phân.
Đáp án chuẩn:
1. NaCl → Na+ + Cl-
2. 2Cl- → Cl2 + 2e
Na+ + 1e → Na
3. 2NaCl ![]() 2Na + Cl2↑
2Na + Cl2↑
Câu hỏi 1: Xét thí nghiệm điện phân dung dịch (đpdd) CuCl2 với điện cực trơ (như than chì).
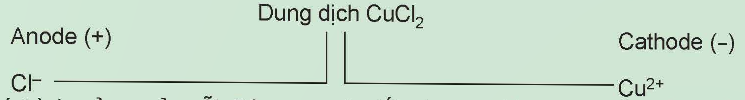
Viết quá trình xảy ra ở mỗi điện cực và viết phương trình hóa học của phản ứng điện phân.
Đáp án chuẩn:
2Cl- → Cl2 + 2e
Cu2+ → Cu + 2e
CuCl2 ![]() Cu + Cl2↑
Cu + Cl2↑
Hoạt động thí nghiệm: Thí nghiệm: Điện phân dung dịch CuSO4
Chuẩn bị:
Hóa chất: dung dịch CuSO4 0,5M.
Dụng cụ: nguồn điện một chiều (3 – 6 vôn), ống thủy tinh hình chữ U, hai điện cực than chì, dây dẫn, kẹp kim loại.
Tiến hành:
- Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như Hình 16.2.
- Rót dung dịch CuSO4 0,5 M vào ống thủy tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
- Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
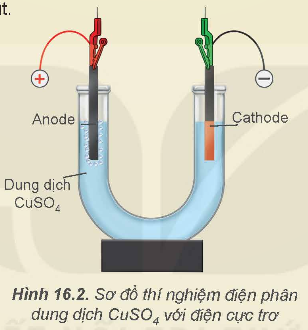
Quan sát hiện tượng xảy ra ở mỗi điện cực và giải thích.
Đáp án chuẩn:
- Sủi bọt khí.
2H2O → O2↑ + 4H+ + 4e
- Cu màu đỏ bám vào điện cực.
Cu2+ + 2e → Cu
Hoạt động nghiên cứu: Điện phân dung dịch NaCl với các điện cực trơ (graphite)
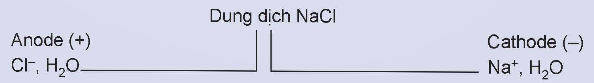
a) Viết quá trình oxi hóa, quá trình khử xảy ra ở mỗi điện cực, biết sản phẩm của quá trình điện phân có khí Cl2 và H2.
b) Viết phương trình hóa học của phản ứng điện phân.
c) Trong quá trình điện phân, sản phẩm tạo thành ở hai điện cực khuếch tán vào nhau sẽ xảy ra phản ứng hóa học nào?
Đáp án chuẩn:
a) 2Cl- → Cl2 + 2e
H2O + 2e → H2 + 2OH-
b) NaCl + H2O ![]() NaOH + H2↑ + Cl2↑
NaOH + H2↑ + Cl2↑
c) Cl2 + 2NaOH → NaCl + NaClO + H2O
Hoạt động thí nghiệm: Thí nghiệm: Thủy phân dung dịch NaCl (tự điều chế nước Javel để tẩy rửa)
Chuẩn bị:
Hóa chất: dung dịch NaCl bão hòa, cánh hoa hồng.
Dụng cụ: nguồn điện một chiều (3 – 6 vôn), cốc thủy tinh 100 mL, hai điện cực than chì, dây dẫn, kẹp kim loại.
Tiến hành:
- Lắp thiết bị thí nghiệm điện phân dung dịch NaCl với điện cực trơ như Hình 16.3.
- Rót khoảng 80 mL dung dịch NaCl bão hòa vào cốc rồi nhúng hai điện cực than chì vào dung dịch.
- Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
- Cho một mẩu cánh hoa hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân
Quan sát hiện tượng quan sát xảy ra và thực hiện các yêu cầu sau:
1. Giải thích hiện tượng quan sát được ở mỗi điện cực.
2. Giải thích khả năng tẩy màu của dung dịch sau điện phân.
3. Tại sao nên dùng nắp đậy trong quá trình điện phân?
Đáp án chuẩn:
1. Cực âm: 2Cl- → Cl2 + 2e
Cực dương: H2O + 2e → H2 + 2OH-
2. Do Cl2 là chất oxy hoá mạnh, có khả năng tẩy màu.
3. Vì ngăn chặn sự bay hơi của dung dịch và chất khí sản phẩm.
II. ỨNG DỤNG CỦA PHƯƠNG PHÁP ĐIỆN PHÂN
Câu hỏi 2:
a) Liệt kê một số đồ vật được mạ kim loại và nêu tác dụng của việc mạ đó.
b) Kể tên một số kim loại được sản xuất bằng phương pháp điện phân.
Đáp án chuẩn:
a) Đồ trang sức, dây cáp điện, chảo, nồi, dây cáp ô tô, ống dẫn nước, thanh ray,… Tác dụng: tăng độ bền, chống sự ăn mòn và cải thiện tính thẩm mĩ.
b) Nhôm, đồng, sắt, kẽm, bạc,…
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận