Giải bài 13 hóa học 10: Liên kết cộng hóa trị
Bài học này trình bày nội dung: Liên kết cộng hóa trị . Dựa vào cấu trúc SGK hóa học lớp 9, Tech12h sẽ tóm tắt lại hệ thống lý thuyết và hướng dẫn giải các bài tập 1 cách chi tiết, dễ hiểu. Hi vọng rằng, đây sẽ là tài liệu hữu ích giúp các em học tập tốt hơn.

A – KIẾN THỨC TRỌNG TÂM
I. Sự hình thành liên kết cộng hóa trị
1. Hình thành liên kết cộng hóa trị trong phân tử đơn chất
- Liên kết cộng hóa trị là liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp eletron chung là một liên kết hóa trị
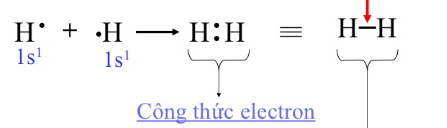
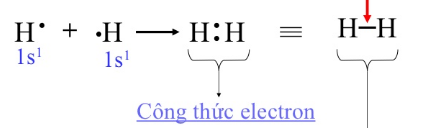
- Các phân tử H2, O2, N2, Cl2.. tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ âm điện như nhau) nên cặp electron chung không bị lệch về phía nguyên tử nào. Đó là liên kết cộng hóa trị không cực.
VD:
2.Hình thành liên kết cộng hóa trị trong phân tử hợp chất
VD: Phân tử hiđro clorua HCl.
- Trong phân tử hiđro, mỗi nguyển tử ( H và Cl) góp 1 electron tạo thành một cặp electron chung để tạo liên kết cộng hóa trị. Cặp electron liên kết bị lệch về phía Clo, ( Độ âm điện của Cl là 3,5 lớn hơn độ âm điện của H là 2,1 ) liên kết cộng hóa trị này bị phân cực.
II. Độ âm điện và liên kết hóa học
- Liên kết ion là trường hợp riêng của liên kết cộng hóa trị
- Hiệu độ âm điện dùng để đánh giá loại liên kết trong phân tử hợp chất:
- Từ 0,0 đến < 0,4 : liên kết cộng hóa trị không cực
- Từ 0,4 đến < 1,7 : liên kết cộng hóa trị có cực
- ≥ 1,7 : liên kết ion.

Bình luận