Dạng bài tập Định luật tuần hoàn
Dạng 2: Định luật tuần hoàn
Bài tập 1: Nguyên tố magnesium thuộc ô số 12, chu kì 3, nhóm IIA. Viết cấu hình electron của magnesium.
Bài tập 2: A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Hãy viết cấu hình electron của A, B và của các ion mà A và B có thể tạo thành.
Bài tập 3: Hòa tan 20,2 gam hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IA trong bảng tuần hoàn tác dụng với nước thu được 6,72 lít khí (đktc) và dung dịch A. Xác định tên và khối lượng hai kim loại.
Bài tập 1:
Nguyên tố magnesium (Mg) ở ô số 12, chu kì 3, nhóm IIA.
Suy ra:
+ Số hiệu nguyên tử Z = 12 = Số electron.
+ Số lớp electron = Số thứ tự chu kì = 3.
+ Số electron lớp ngoài cùng = Số thứ tự nhóm A = 2.
→Cấu hình electron của nguyên tử magnesium (Mg): 1s22s22p63s2 hay [Ne]3s2.
Bài tập 2:
- Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
- Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
- Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; D = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
Bài tập 3:
- Gọi R là kí hiệu chung của hai kim loại nhóm IA, R cũng là nguyên tử khối trung bình của hai kim loại.
2R + 2H2O → 2ROH + H2 ↑
0,6 0,3
nH2 = 6,72/22,4 = 0,3 (mol)
R = 20,2/0,6 = 33,67
- Vì hai kim loại thuộc hai chu kì liên tiếp nên một kim loại phải có nguyên tử khối nhỏ hơn 33,67 và kim loại còn lại có nguyên tử khối lớn hơn 33,67.
- Vậy ta có: R1 = 23 (Na) < R = 33,67 < R2 = 39 (K)
- Dựa vào bảng tuần hoàn hai kim loại đó là Na, K
2Na + 2H2O → 2NaOH + H2 ↑
x x/2
2K + 2H2O → 2KOH + H2 ↑
y y/2
Ta có hệ phương trình:
mNa = 23.0,2 = 4,6 (gam)
mK = 39.0,4 = 15,6 (gam)

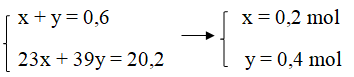
Bình luận