Đề cương ôn tập Hóa học 10 kết nối tri thức học kì 1 (P3)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách Kết nối tri thức mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ: LIÊN KẾT HÓA HỌC
1. Liên kết ion
- Liên kết ion trong phân tử hay tinh thể được tạo thành nhờ lực hút tĩnh điện của các ion mang điện tích trái dấu. Liên kết ion thường tạo thành từ các nguyên tử kim loại điển hình và phi kim điển hình, phân tử thu được là hợp chất ion.
Chú ý: Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation) còn nguyên tử phi kim nhận electron để trở thành ion mang điện tích âm (anion).
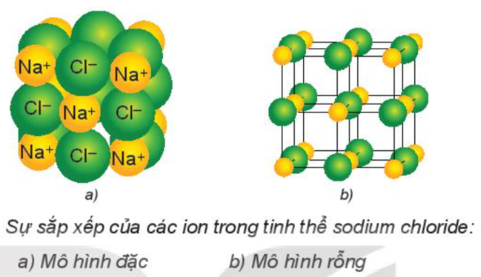
- Tinh thể ion: Cấu trúc của mạng tinh thể ion: các ion được sắp xếp theo trật tự nhất định trong không gian theo kiểu mạng lưới (ở các nút mạng là các ion dương và ion âm xếp luân phiên liên kết chặt chẽ với nhau do cân bằng lực hút và lực đẩy).
Ví dụ: Tinh thể muối ăn:
2. Liên kết cộng hóa trị
- Liên kết cộng hóa trị được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Kiểu liên kết: Liên kết đơn (–), liên kết đôi (=), liên kết ba (º).
+ Liên kết cộng hóa trị không phân cực là liên kết trong các phân tử mà cặp electron dùng chung không bị hút lệch về phía nguyên tử nào.
+ Liên kết cộng hóa trị phân cực liên kết trong phân tử mà cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn.
+ Liên kết cho – nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
- Dựa vào sự khác nhau về độ âm điện giữa các nguyên tử tham gia liên kết, có thể dự đoán được loại liên kết giữa hai nguyên tử đó.

3. Liên kết hydrogen và tương tác van der Waals
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
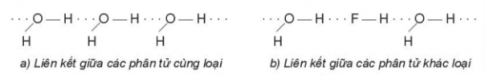
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Ví dụ: Ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu là tương tác van der Waals.
- Liên kết hydrogen và tương tác van der Waals đều làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.

Bình luận