Đề cương ôn tập Hóa học 10 kết nối tri thức học kì 2 (P2)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách Kết nối tri thức mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 2 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ: TỐC ĐỘ PHẢN ỨNG VÀ NGUYÊN TỐ NHÓM HALOGEN
1. Tốc độ phản ứng
- Xét phản ứng hóa học dạng tổng quát: aA + bB → cC + dD
- Biểu thức tốc độ trung bình của phản ứng:
- Trong đó: DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt.
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: v = k.(CA)a.(CB)b
- Các yếu tố ảnh hưởng đến tốc độ phản ứng
+ Nồng độ: Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
+ Áp suất: Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
+ Nhiệt độ: Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng.
+ Diện tích bề mặt tiếp xúc: Để tăng tốc độ phản ứng, ta có thể tăng diện tích bề mặt tiếp xúc của chất phản ứng bằng cách làm giảm kích thước hạt rắn hoặc tạo những hạt xốp.
+ Chất xúc tác: Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng.
2. Nguyên tố nhóm halogen
- Nguyên tử halogen: Cấu hình lớp electron ngoài cùng của các nguyên tử halogen có dạng: ns2np5 (có 7 electron ở lớp ngoài cùng).
→ Xu hướng: dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất: X + 1e → X-
- Đơn chất halogen
+ Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
+ Tính oxi hóa giảm dần từ fluorine đến iodine.
- Hydrogen halide
+ Nhiệt độ sôi của các hydrogen halide
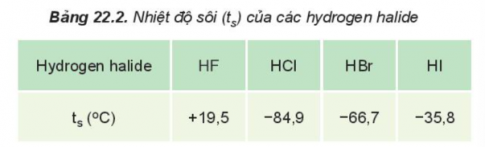
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H−F⋅⋅⋅H−F⋅⋅⋅H−F⋅⋅⋅
Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
+ Xu hướng biến đổi tính acid: Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
- Muối halide
Phân biệt các ion F-, Cl-, Br-, I- trong dung dịch muối và acid:
Dùng dung dịch silver nitrate (AgNO3) để phân biệt các ion halide (X-).
Trong đó:
+ Khi X- là F- thì không thấy sự biến đổi, do không có phản ứng hóa học xảy ra.
+ Khi X- là Cl- thì xuất hiện kết tủa trắng silver chloride (AgCl).
+ Khi X- là Br- thì xuất hiện kết tủa màu vàng nhạt silver bromide (AgBr).
+ Khi X- là I- thì xuất hiện kết tủa màu vàng silver iodide (AgI).

Bình luận