Đề cương ôn tập Hóa học 10 kết nối tri thức học kì 1 (P2)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách Kết nối tri thức mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
1. Cấu tạo bảng tuần hoàn
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron ⇒ cùng chu kì (hàng).
- Cùng số electron hóa trị ⇒ cùng nhóm (cột).
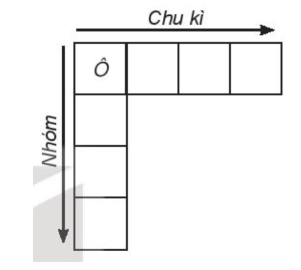
- Trong bảng tuần hoàn hiện nay có 118 nguyên tố, 7 chu kì, 18 cột (8 cột nhóm A và 10 cột nhóm B) chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi nhóm là 1 cột, riêng nhóm VIIIB gồm 3 cột.
2. Xu hướng biến đổi trong bảng tuần hoàn
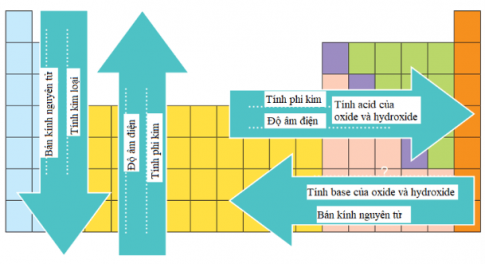
- Bán kính nguyên tử
+ Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
+ Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
- Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
+ Độ âm điện tăng từ trái qua phải trong một chu kì.
+ Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
- Tính kim loại, tính phi kim
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
+ Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
- Tính acid – base của các oxide và hydroxide: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
- Bảng tuần hoàn và cấu tạo nguyên tử
+ Số Z = số proton = số electron = số hiệu nguyên tử
+ Số lớp electron = số thứ tự chu kì
+ Số electron lớp ngoài cùng = số thứ tự nhóm A
3. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.

Bình luận