Đề cương ôn tập Hóa học 7 kết nối tri thức học kì 1
Đề cương ôn tập môn Hóa học lớp 7 bộ sách Kết nối tri thức mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 7. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
1. NGUYÊN TỬ
- Nguyên tử là một hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử có hạt nhân ở tâm mang điện tích dương và các electron mang điện tích âm, chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh Mặt Trời (mẫu hành tinh nguyên tử).
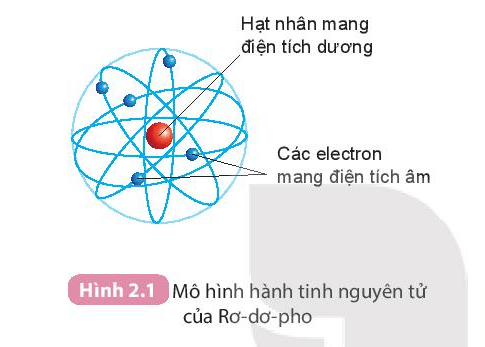
- Hạt nhân nguyên tử gồm các hạt proton (p) mang điện tích dương và các hạt neutron (n) không mang điện.
Số đơn vị điện tích hạt nhân, kí hiệu là Z, bằng tổng số proton có trong hạt nhân.
- Vỏ nguyên tử gồm các hạt electron mang điện tích âm sắp xếp thành từng lớp. Lớp electron trong cùng chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất. Các lớp electron khác chứa tối đa 8 electron hoặc nhiều hơn và bị hạt nhân hút yếu hơn.
- Khối lượng nguyên tử tập trung ở hạt nhân, được coi bằng khối lượng của hạt nhân và có đơn vị amu.
Ví dụ: Nguyên tử đồng có 29 proton, 29 electron, 35 neutron
Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
⇒ Khối lượng của nguyên tử đồng là 29.1amu + 35.1 amu = 64 amu
2. NGUYÊN TỐ HÓA HỌC
- Những nguyên tử có cùng số proton thuộc cùng một nguyên tố hóa học. Các nguyên tử thuộc cùng một nguyên tố hóa học có thể có số neutron khác nhau.
Ví dụ: Oxygen trong tự nhiên chứa các nguyên tử oxygen cùng có 8 proton trong hạt nhân nhưng có số neutron khác nhau (8 neutron, 9 neutron hoặc 10 neutron).
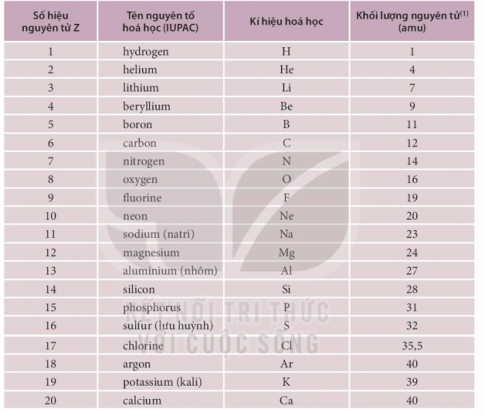
Đến nay, con người đã tìm ra 118 nguyên tố hóa học. Mỗi nguyên tố hóa học có tính chất riêng biệt do được tạo thành từ các nguyên tử có số proton xác định.
- Kí hiệu nguyên tố hóa học gồm một hoặc hai chữ cái có trong tên gọi của nguyên tố, trong đó hai chữ cái đầu được viết ở dạng in hoa và chữ cái sau viết thường.
3. SƠ LƯỢC VỀ BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. Các nguyên tố trong cùng một chu kì có cùng số lớp electron, các nguyên tố trong cùng một nhóm có tính chất gần giống nhau.
- Cấu trúc bảng tuần hoàn gồm các ô nguyên tố, chu kì và nhóm.
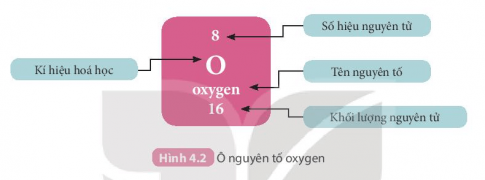
- Ô nguyên tố cho biết: kí hiệu hóa học, tên nguyên tố, kí hiệu nguyên tử và khối lượng nguyên tử của nguyên tố đó.
+ Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số electron trong nguyên tử.
+ Số hiệu nguyên tử chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ:
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần khi đi từ trái sang phải.
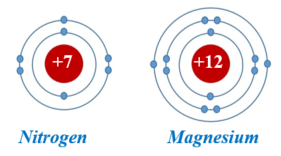
+ Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
- Các nguyên tố trong cùng một nhóm A có số electron ở lớp ngoài cùng bằng nhau (trừ trường hợp nguyên tố He), do vậy chúng có tính chất gần giống nhau.
+ Trong một nhóm, khi đi từ trên xuống dưới điện tích hạt nhân nguyên tử của các nguyên tố tăng dần.
+ Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm đó.
- Trong bảng tuần hoàn, các nguyên tố kim loại tập trung ở các nhóm IA, IIA, IIIA và các nhóm B. Các nguyên tố phi kim tập trung ở các nhóm VA, VIA, VIIA, còn các nguyên tố khí hiếm ở nhóm VIIIA.


Bình luận