Dễ hiểu giải hóa học 10 kết nối bài 14: Ôn tập chương 3
Giải dễ hiểu bài 14: Ôn tập chương 3. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 10 Kết nối dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 14. ÔN TẬP CHƯƠNG 3
I. HỆ THỐNG HÓA KIẾN THỨC
Hoàn thành sơ đồ hệ thống hoá kiến thức sau:
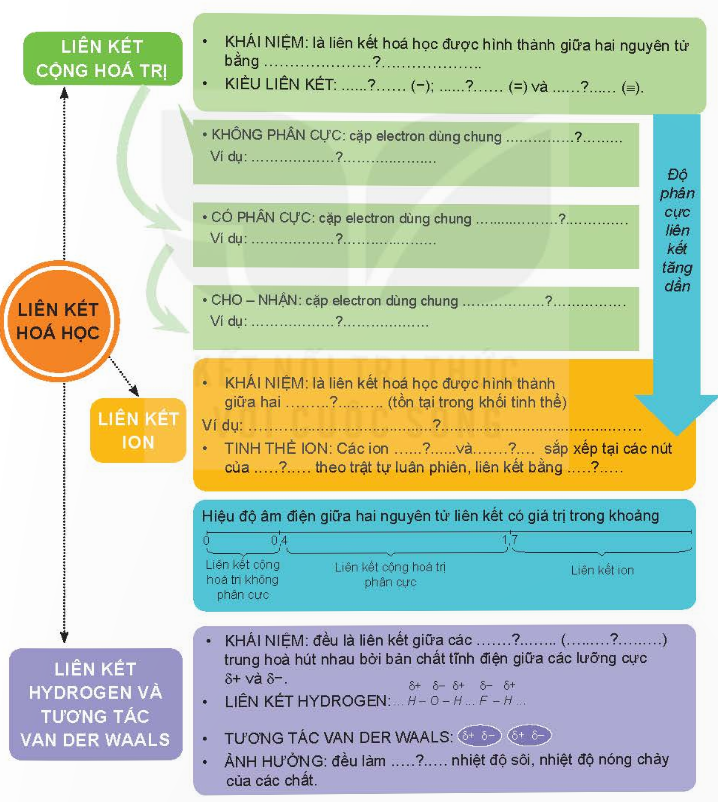
Giải nhanh:
(1) một hay nhiều cặp electron dùng chung; (2) liên kết đơn; (3) liên kết đôi; (4) liên kết ba.
(5) nằm chính giữa hai nguyên tử; (6) Cl2, Br2,…
(7) lệch về nguyên tử có độ âm điện lớn hơn; (8) H2O, CO, NH3,…
(9) do một nguyên tử đóng góp; (10) SO2, HNO3,…
(11) tinh thể ion; (12) NaCl
(13) ion mang điện tích trái dấu; (14) NaCl, NaF, CaCl2.
(15) âm; (16) dương; (17) mạng tinh thể; (18) lực hút tĩnh điện của chúng
(19) phân tử (hay nguyên tử)
(20) tăng
II. LUYỆN TẬP
Câu 1: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
A. Cl2, Br2, I2, HCl. B. Na2O, KCl, BaCl2, Al2O3.
C. HCl, H2O, NaCl, N2O D. MgO, H2SO4, H3PO4, HCl.
Giải nhanh:
Chọn đáp án B.
Câu 2: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực?
A. N2, CO2, Cl2, H2 B. N2, Cl2, H2, HCl
C. N2, HI, Cl2, CH4 D. Cl2, O2, N2, F2.
Giải nhanh:
Chọn đáp án D.
Câu 3: Viết công thức cấu tạo và công thức Lewis của các phân tử sau: PH3, H2O, C2H6. Trong phân tử nào có liên kết phân cực mạnh nhất?
Giải nhanh:
- Công thức cấu tạo:
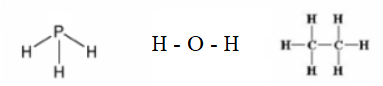
- Công thức Lewis:
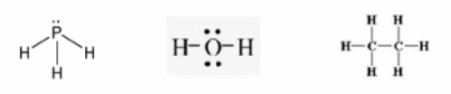
Câu 4: Dựa vào giá trị độ âm điện của các nguyên tử trong Bảng 6.2, xác định loại liên kết trong phân tử các chất: CH4, CaCl2, HBr, NH3.
Giải nhanh:
- CH4, NH3: liên kết cộng hóa trị không phân cực
- CaCl2: liên kết ion
- HBr: liên kết cộng hóa trị phân cực
Câu 5: Cho dãy các oxide sau: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
b) Dựa vào giá trị độ âm điện của các nguyên tố trong Bảng 6.2, cho biết loại liên kết (ion, cộng hóa trị phân cực, cộng hóa trị không phân cực) trong từng phân tử oxide.
Giải nhanh:
a) Nó tăng dần.
b) Na2O, MgO, Al2O3: liên kết ion
SiO2, P2O5: liên kết cộng hóa trị phân cực.
SO3, Cl2O7: liên kết cộng hóa trị không phân cực.
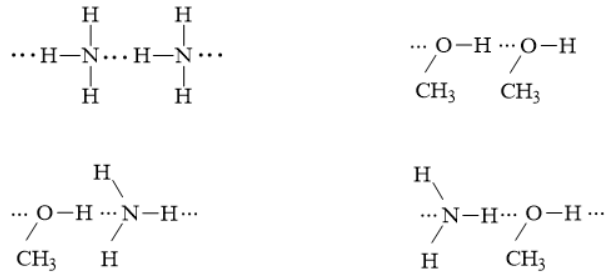
Câu 6: a) Cho dãy các phân tử: C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó.
Giải nhanh:
a) CH3OH và NH3. Vì trong phân tử chứa O và N có độ âm điện lớn và cặp e chưa liên kết và nguyên tử H linh động.
b)
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận