Dễ hiểu giải hóa học 10 kết nối bài 21: Nhóm halogen
Giải dễ hiểu bài 21: Nhóm halogen. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 10 Kết nối dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 21: NHÓM HALOGEN
MỞ ĐẦU
Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn tại ở cả dạng đơn chất và hợp chất, còn các halogen đều chỉ tồn tại ở dạng hợp chất. Vì sao có sự khác biệt này?
Giải nhanh:
Vì các halogen có tính oxi hoá mạnh nên phản ứng với các chất trong tự nhiên tạo hợp chất.
I. TRẠNG THÁI TỰ NHIÊN
Câu 1: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên.
Giải nhanh:
CaF2 (fluorite), Na3AlF6 (cryolite), NaCl (halite), KCl.MgCl26H2O (carnallite)…
II. CẤU TẠO NGUYÊN TỬ, PHÂN TỬ
Hoạt động 1:
1. Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen theo mẫu sau:
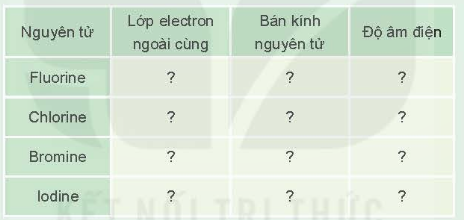
Từ bảng số liệu thu được, hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chúng 1 electron với nguyên tử phi kim để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hoá từ F đến I.
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hoá -1 trong các hợp chất?
2. Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy:
a) Mô tả sự hình thành liên kết trong phân tử halogen bằng công thức electron
b) Liên kết trong phân tử halogen là liên kết cộng hoá trị phân cực hay không phân cực?
c) Dựa vào bán kính nguyên tử (Hình 6.2), hãy dự đoán xu hướng biến đổi độ dài liên kết trong dãy các phân tử halogen.
Giải nhanh:
1.
Nguyên tử | Lớp electron ngoài cùng | Bán kính nguyên tử | Độ âm điện |
Fluorine | 7 | 72 pm | 3,98 |
Chlorine | 7 | 100 pm | 3,16 |
Bromine | 7 | 114 pm | 2,96 |
Iodine | 7 | 133 pm | 2,66 |
a) Vì nó có 7 electron lớp ngoài cùng.
b) - Từ F đến I bán kính nguyên tử tăng dần vì lực hút giữa hạt nhân và các e lớp ngoài cùng giảm.
- Từ F đến I độ âm điện giảm vì số lớp e tăng nên lực hút giữa hạt nhân với e lớp ngoài cùng giảm.
- Tính oxi hoá giảm dần từ F đến I
c) Vì nó có độ âm điện lớn nhất nên có xu hướng hút e về mình và nó có 7 e lớp ngoài cùng.
2. a)
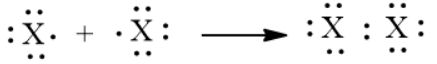
b) Là liên kết cộng hoá trị không phân cực
c) Độ dài liên kết tăng dần từ F2 đến I2.
Hoạt động 2:
1. Xác định số oxi hoá của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4.
2. Từ các số oxi hoá của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hoá vừa có tính khử?
Giải nhanh:
1. Lần lượt là 0; -1; +1; +3; +5; +7.
2. Vì nó có số oxi hoà là 0 ở mức trung gian.
Câu 2: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế.
Giải nhanh:
- F: NaF, Ca5(PO4)3F, HF…
- Cl: NaCl, CaOCl2, KClO3,…
- Br: AgBr…
- I: KI, KIO3…
Câu 3: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim.
Hãy mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh họa.
Giải nhanh:
- NaCl: nguyên tử Na nhường 1e, nguyên tử Cl nhận 1e để đạt cấu hình bền vững.
- HCl: nguyên tử H nhường 1e, nguyên tử Cl nhận 1e để đạt cấu hình bền vững.
III. TÍNH CHẤT VẬT LÍ
Câu 4: Từ bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích.
Giải nhanh:
Nhiệt độ sôi và nhiệt độ nóng chảy tăng dần từ F2 đến I2. Vì từ F2 đến I2, tương tác van der Waals tăng do kích thước phân tử và số electron tăng.
IV. TÍNH CHẤT HOÁ HỌC
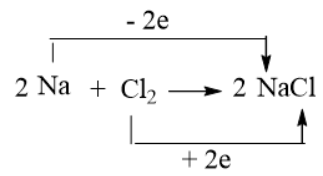
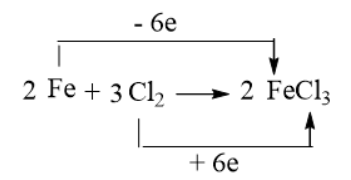
Câu 5: Xác định chất oxi hóa, chất khử trong phản ứng của sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hóa.
Giải nhanh:
Na → Na+1 + 1e Na là chất khử Fe → Fe+3 + 3e Fe là chất khử
Cl2 + 2e → 2Cl- Cl2 là chất oxi hoá
Hoạt động: Xét các phản ứng hoá học: H2(g) + X2(g) → 2HX(g) (X là các halogen).
Tra số liệu trong Bảng 12.2 để:
1. Giải thích xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của các halogen.
2. Dựa vào số liệu năng lượng liên kết H – X, giải thích xu hướng phản ứng giảm dần từ F2 đến I2.
Giải nhanh:
1. Do từ fluorine đến iodine, tính oxi hóa giảm dần.
2. Do năng lượng liên kết H – X giảm dần từ H – F đến H – I.
Câu 6: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lương Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt.
Giải nhanh:
Đổi: 80000 m3 = 80000000 L.
Khối lượng Cl2 = ![]() kg
kg
Hoạt động: Tìm hiểu tính tẩy màu của khí chlorine ẩm
Tiến hành:
Đính một mẩu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác chứa khí chlorine (Hình 21.6).
Quan sát hiện tượn và thực hiện yêu cầu sau:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích.
2. Xác định vao trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hoá – tự khử trong phản ứng này?
Giải nhanh:
1. Lúc sau mẩu giấy mất màu do lúc này sinh ra HClO có tính oxi hóa mạnh, có khả năng tẩy màu. PTHH: Cl2 + H2O ⇄ HCl + HClO
2. Vì nó có một nguyên tử Cl đóng vai trò là chất oxi hóa, một nguyên tử Cl đóng vai trò là chất khử.
Câu 7: Khí Cl2 phản ứng với dung dịch sodium hdroxide nóng tạo thành sodium chloride, sodium chlorate và nước.
Lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
Giải nhanh:
Cl2 vừa là chất oxi hoá vừa là chất khử.
Quá trình khử: 5 x | Cl2 + 2e → 2Cl-
Quá trình oxi hoá: Cl2 → 2Cl+5 + 10e
PTHH: 3Cl2 + 6NaOH ![]() 5NaCl + NaClO + 3H2O
5NaCl + NaClO + 3H2O
Hoạt động: Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3).
- Thêm vào mỗi ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vào giọt nước Br2, lắc đều các ống nghiệm.
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm.
2. So sánh tính oxi hoá của Cl2, Br2, I2.
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodine.
Giải nhanh:
1. – Ống 1: dung dichjchuyeenr màu vàng
- Ống 2: dung dịch màu vàng và có chất rắn màu đen tím
- Ống 3: dung dịch màu vàng nhạt dần và có chất rắn màu đen tím.
2. Tính oxi hoá Cl2 > Br2 > I2.
3. Dùng hồ tinh bột.
V. ĐIỀU CHẾ CHLORINE
Câu 9: Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm. Còn Cl2 được tạo thành ở cực dương.Tại sao cần sử dụng màng ngăn xốp để ngăn cách hai điện cực?
Giải nhanh:
Vì để ngăn không cho sản phẩm phản ứng với nhau. Nếu không có vách ngăn sẽ tạo sản phẩm nước Javel.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận