Dễ hiểu giải hóa học 10 kết nối bài 16: Ôn tập chương 4
Giải dễ hiểu bài 16: Ôn tập chương 4. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 10 Kết nối dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 16: ÔN TẬP CHƯƠNG 4
I. HỆ THỐNG HOÁ KIẾN THỨC
Hoàn thành các nội dung còn thiếu sau đây:
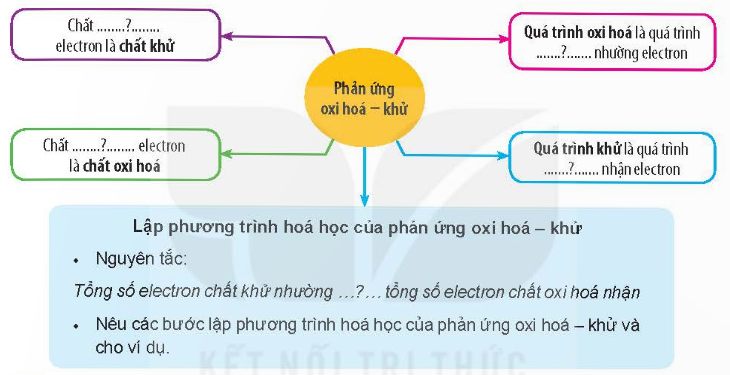
Giải nhanh:
(1) nhường; (2) nhận; (3) chất khử; (4) chất oxi hóa; (5) bằng
II. LUYỆN TẬP
Câu 1:Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
A. nhận electron B. nhường proton
C. nhường electron D. nhận proton.
Giải nhanh:
Chọn đáp án A.
Câu 2:Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã:
A. nhường 2 electron B. nhận 2 electron
C. nhường 1 electron D. nhận 1 electron.
Giải nhanh:
Chọn đáp án A.
Câu 3: Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là:
A. H2O B. NaOH C. Na D. H2
Giải nhanh:
Chọn đáp án A.
Câu 4: Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hóa học:
Cl2 + 2NaBr → 2NaCl + Br2
Trong phản ứng hóa học trên xảy ra quá trình oxi hóa chất nào?
A. NaCl B. Br2 C. Cl2 D. NaBr.
Giải nhanh:
Chọn đáp án D.
Câu 5: Xét các phản ứng hoá học xảy ra trong các quá trình sau:
a) Luyện gang từ quặng hematite đỏ:
Fe2O3 + CO ![]() FeO + CO2 FeO + CO
FeO + CO2 FeO + CO ![]() Fe + CO2
Fe + CO2
b) Luyện zinc (kẽm) từ quặng blend:
ZnS + O2 ![]() ZnO + SO2 ZnO + C
ZnO + SO2 ZnO + C ![]() Zn + CO
Zn + CO
c) Sản xuất xút, chlorine từ dung dịch muối ăn:
NaCl + H2O ![]() NaOH + Cl2 + H2
NaOH + Cl2 + H2
d) Đốt chát ethanol có trong xăng E5:
C2H5OH + O2 ![]() CO2 + H2O
CO2 + H2O
Hãy chỉ ra các phản ứng oxi hoá – khử, lập phương trình hoá học của các phản ứng đó theo phương pháp thăng bằng electron và chỉ rõ chất oxi hoá, chất khử
Giải nhanh:
Cả 4 đều là phản ứng oxi hoá – khử
a) Chất oxi hoá: Fe2O3, FeO; chất khử: CO
2Fe+3 + 2e → 2Fe+2 C+2 → C+4 + 2e
PTHH: Fe2O3 + CO ![]() 2FeO + CO2
2FeO + CO2
Fe+2 + 2e → Fe C+2 → C+4 + 2e
PTHH: FeO + CO ![]() Fe + CO2
Fe + CO2
b) Chất oxi hoá: O2, ZnO; chất khử: O2, C
S-2 → S+4 + 6e O2 + 4e → 2O-2
PTHH: 2ZnS + 3O2 ![]() 2ZnO + 2SO2
2ZnO + 2SO2
Zn+2 + 2e → Zn C → C+2 + 2e
PTHH: ZnO + CO ![]() Zn + CO2
Zn + CO2
c) Chất oxi hoá: H2O; chất khử: NaCl
2H+1 + 2e → H2 2Cl-1 → Cl2 + 2e
PTHH: 2NaCl + 2H2O ![]() 2NaOH + Cl2 + H2
2NaOH + Cl2 + H2
d) Chất oxi hoá: O2; chất khử: C2H5OH
O2 + 4e → 2O-2 2C-2 → 2C+4 + 12e
PTHH: C2H5OH + 3O2 ![]() 2CO2 + 3H2O
2CO2 + 3H2O
Câu 6: Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 → NO + H2O
Trong công nghiệp, cần trộn 1 thể tích khí ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện về nhiệt độ và áp suất.
Giải nhanh:
PTHH: 4NH3 + 5O2 → 4NO + 6H2O
1V → 1,25V
Vkk = ![]()
Câu 7: Copper(II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thước Bordaux (trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp)…
Trong công nghiêp, copper(II) sulfate thường được sản xuất bằng cách ngâm đồng phế liệu trong dung dịch dusulfuric acid loãng và sục không khí:
Cu + O2 + H2SO4 → CuSO4 + H2O (1)
a) Lập phương trính hóa học của phản ứng (1) theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
b) Copper(II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
Cu + H2SO4 (đặc) ![]() CuSO4 + SO2 + H2O (2)
CuSO4 + SO2 + H2O (2)
Trong hai cách trên, cách nào sử dựng ít sulfuric acid hơn, cách nào ít gây ô nhiễm môi trường hơn ?
Giải nhanh:
a) Chất khử: Cu, chất oxi hoá: O2
Cu → Cu+2 + 2e
O2 + 4e → 2O-2
PTHH: 2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O (1)
b) Cu + 2H2SO4 (đặc) ![]() CuSO4 + SO2 + 2H2O (2)
CuSO4 + SO2 + 2H2O (2)
- Theo (1), 1 mol Cu cần 1 mol H2SO4.
- Theo (2), 1 mol Cu cần 2 mol H2SO4.
Vậy nên dùng cách 1.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận