Dễ hiểu giải hóa học 10 kết nối bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Giải dễ hiểu bài 17: Biến thiên enthalpy trong các phản ứng hóa học. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 10 Kết nối dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 17: BIẾN THIÊN ENTHALPY TRONG CÁC PHẢN ỨNG HOÁ HỌC
MỞ ĐẦU
Phản ứng giữa đường glucose với oxygen tạo ra carbon dioxide, hơi nước và toả nhiều nhiệt. Sau khi chơi thể thao, cơ thể mệt mỏi, nghỉ ngơi một vài phút, sau đó nếu uống một cốc nước hoa quả, em sẽ cảm thấy khoẻ hơn. Có phải đường glucose đã “cháy” và cấp bù năng lượng cho cơ thể?
Giải nhanh:
Có, vì glucose trong nước hoa quả bù phần nước mà cơ thể mất.
I. PHẢN ỨNG TOẢ NHIỆT, PHẢN ỨNG THU NHIỆT
Câu 1: Khi đun nóng ống nghiệm đựng KmnO4 (thuốc tím), nhiệt của ngọn lửa làm cho KMnO4
Bị nhiệt phân, tạo hỗn hợp bột màu đen:
KMnO4 → K2MnO4 + MnO2 + O2
Em hãy dự đoán phản ứng này toả nhiệt hay thu nhiệt.
Giải nhanh:
Phản ứng thu nhiệt.
Hoạt động: Theo dõi sự thay đổi nhiệt độ của phản ứng trung hoà
Chuẩn bị: dung dịch HCl 0,5 M, dung dịch NaOH 0,5 M, 1 cốc 250 mL, giá treo nhiệt kế, nhiệt kế (có dải đo đến 100 oC), que khuấy và 2 ống đong 50 mL.
Tiến hành:
- Dùng ống đong lấy 50 mL dung dịch HCl 0,5 M cho vào cốc phản ứng, lắp nhiệt kế lên giá sao cho đầu nhiệt kế nhúng vào dung dịch trong cốc (Hình 17.1). Đọc nhiệt độ dung dịch.
- Dùng ống đong khác laasy 50 mL dung dịch NaOH 0,5 M cho vào cốc phản ứng. Khuấy nhẹ.
Theo dõi sự thay đổi nhiệt độ của dung dịch và trả lời câu hỏi:
1. Nhiệt độ trên nhiệt kế thay đổi như thế nào sau khi rót dung dịch NaOH vào cốc? Phản ứng trung hoà là phản ứng toả nhiệt hay thu nhiệt?
2. Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ thay đổi như thế nào so với thí nghiệm trên?
Giải nhanh:
1. Nhiệt độ tăng dần nên là phản ứng toả nhiệt.
2. Thì nhiệt độ tăng chậm hơn.
II. BIẾN THIÊN ENTHAPY CỦA PHẢN ỨNG
Câu 2: Cho các phương trình nhiệt hóa học:
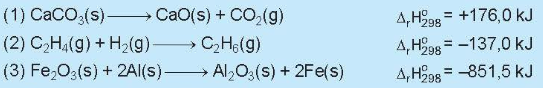
Trong các phản ứng trên, phản ứng nào tỏa nhiệt, phản ứng nào thu nhiệt?
Giải nhanh:
Thu nhiệt: (1). Toả nhiệt: (2) và (3).
Câu 3: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO(g) + ![]() O2(g) → CO2(g)
O2(g) → CO2(g) ![]()
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng tỏa ra là bao nhiêu?
Giải nhanh:
Nhiệt lượng: ![]()
Câu 4: Phản ứng tôi vôi tỏa ra nhiệt lượng rất lớn, có thể làm sôi nước. Hãy nêu các biện pháp để đảm bảo an toàn khi thực hiện quá trình tôi vôi.
Giải nhanh:
Cần cho từ từ từng viên CaO vào bể nước dư.
III. TÍNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG THEO NHIỆT TẠO THÀNH
Câu 5: Cho phản ứng:
C(kim cương) → C(graphite) ![]()
a) Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
b) Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2 → CO2(g), carbon ở dạng kim cương hay graphite?
Giải nhanh:
a) Của graphite thấp hơn.
b) Nó ở dạng graphite.
Câu 6: Từ bảng 17.1, hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane:
C2H6(g) + ![]() O2
O2 ![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l)
Giải nhanh:
![]()
IV. TÍNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG THEO NĂNG LƯỢNG LIÊN KẾT
Câu 7: a) Cho biết năng lượng liên kết các phân tử O2, N2 và NO lần lượt là 494kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng:
N2(g) + O2(g) → 2NO(g)
b) Giải thích vì sao nitrogen chỉ phản ứng với oxyden ở nhiệt độ cao hoặc khi có tia lửa điện.
Giải nhanh:
a)![]()
b) Vì năng lượng cần cung cấp là rất lớn mà đây là phản ứng thu nhiệt.
Câu 8: Từ số liệu năng lượng liên kết ở bảng 12.2, hãy tính biến thiên enthalpy của phản ứng đốt cháy butane theo năng lượng liên kết, biết sản phẩm phản ứng đều ở thể khí.
Giải nhanh:
C4H10 + ![]() O2 → 4CO2 + 5H2O
O2 → 4CO2 + 5H2O
![]()
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận