Giáo án Hoá học 9 mới năm 2024 cánh diều
Bộ giáo án Khoa học tự nhiên 9 (Hoá học) cánh diều. Đây là giáo án sách lớp 9 mới năm học 2024 - 2025. Giáo án có đầy đủ các bài kì 1 + kì 2 với cách trình bày khoa học, chi tiết. Giáo viên chỉ việc tải về và sử dụng. Cách tải đơn giản. Giáo án Hoá học 9 cánh diều là giáo án bản word, dễ dàng chỉnh sửa.
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 
.....
=> Phía trên chỉ là hiển thị 1 phần giáo án. Tài liệu khi tải về sẽ có đầy đủ nội dung bài học
Đầy đủ Giáo án hóa học THCS cánh diều
- Bài giảng điện tử Hoá học 9 cánh diều
- Giáo án Hoá học 9 mới năm 2024 cánh diều
- Bài giảng điện tử hóa học 8 cánh diều
- Giáo án hóa học 8 mới năm 2023 cánh diều
- Bài giảng Powerpoint hóa học 7 cánh diều
- Tải GA word hóa học 7 cánh diều
- Bài giảng điện tử hóa học 6 cánh diều
Ngày soạn:…/…/…
Ngày dạy:…/…/…
PHẦN 2: CHẤT VÀ SỰ BIẾN ĐỔI CỦA CHẤT
CHỦ ĐỀ 6: KIM LOẠI
BÀI 15. TÍNH CHẤT CHUNG CỦA KIM LOẠI
- MỤC TIÊU
- Về kiến thức
BÀI 15. TÍNH CHẤT CHUNG CỦA KIM LOẠI
- MỤC TIÊU
- Về kiến thức
Sau bài học này, HS sẽ:
- Nêu được tính chất vật lí của kim loại.
- Trình bày được tính chất hóa học cơ bản của kim loại: Tác dụng với phi kim (oxygen, lưu huỳnh, chlorine), nước hoặc hơi nước, dung dịch hydrochloric acid, dung dịch muối.
- Mô tả được một số khác biệt về tính chất giữa các kim loại thông dụng (nhôm, sắt, vàng,...).
- Năng lực
Năng lực chung:
- Năng lực giao tiếp và hợp tác: Chủ động giao tiếp trong nhóm, trình bày rõ ý tưởng cá nhân và hỗ trợ nhau hoàn thành nhiệm vụ chung, tự tin và biết kiểm soát cảm xúc, thái độ khi nói trước nhiều người.
- Năng lực giải quyết vấn đề và sáng tạo:Thu thập và làm rõ thông tin có liên quan đến vấn đề; phân tích để xây dựng được các ý tưởng phù hợp.
Năng lực đặc thù:
- Năng lực vận dụng kiến thức, kĩ năng đã học:Nhận ra, giải thích được vấn đề thực tiễn dựa trên kiến thức khoa học tự nhiên.
- Năng lực tìm hiểu tự nhiên:
- Sử dụng được ngôn ngữ, hình vẽ, sơ đồ, biểu bảng để biểu đạt quá trình tìm hiểu vấn đề và kết quả tìm kiếm.
- Viết được báo cáo sau quá trình tìm hiểu.
- Năng lực nhận thức khoa học tự nhiên:
- Nêu được tính chất vật lí của kim loại.
- Trình bày được tính chất hóa học cơ bản của kim loại: Tác dụng với phi kim (oxygen, lưu huỳnh, chlorine), nước hoặc hơi nước, dung dịch hydrochloric acid, dung dịch muối.
- Mô tả được một số khác biệt về tính chất giữa các kim loại thông dụng (nhôm, sắt, vàng,...).
- Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn trọng, trung thực và thực hiện các yêu cầu trong bài học.
- THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Đối với giáo viên
- Tài liệu: SGK, SGVKhoa học Tự nhiên 9, các hình ảnh về kim loại và ứng dụng của kim loại trong đời sống, video về một số phản ứng hóa học của kim loại, phiếu bài tập.
- Thiết bị dạy học: Máy tính, máy chiếu.
- Đối với học sinh
- Tài liệu: SGKKhoa học Tự nhiên 9
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG
- Mục tiêu: HS có hứng thú học tập, nhu cầu tìm hiểu; dùng những kiến thức, kĩ năng cần thiết để thực hiện yêu cầu, khám phá kiến thức mới.
- Nội dung: Quan sát hình ảnh GV cung cấp và thực hiện yêu cầu theo hướng dẫn của GV.
- Sản phẩm:Câu trả lời của HS về tính chất của kim loại trong hình.
- Tổ chức thực hiện
Bước 1: GV chuyển giao nhiệm vụ học tập
- GV yêu cầu HS quan sát các hình ảnh về các vật dụng được làm từ kim loại:
|
|
|
|
- GV nêu câu hỏi: Em hãy quan sát và cho biết các vật dụng trên được làm từ kim loại nào?
- GV nêu vấn đề trong hoạt động mở đầu: Em hãy cho biết tính chất của các vật dụng được làm từ vật liệu kim loại trong hình?
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS làm việc cá nhân, quan sát hình và suy nghĩ trả lời câu hỏi của GV.
- GV hướng dẫn, hỗ trợ HS (nếu cần thiết).
Bước 3: Báo cáo kết quả hoạt động, thảo luận
- GV mời 2 – 3 HS trả lời câu hỏi:
|
Vật dụng |
Kim loại sử dụng |
Tính chất |
|
Xoong |
Nhôm |
Dẫn nhiệt |
|
Dây dẫn điện |
Đồng |
Dẫn điện |
|
Khung cửa sổ |
Sắt |
Tính dẻo |
- Các HS khác lắng nghe để nhận xét câu trả lời của bạn mình.
- GV khuyến khích HS có thể có nhiều ý kiến khác nhau trong quá trình thực hiện bài tập.
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV nhận xét, đánh giá, dẫn dắt HS vào bài học: Kim loại có vai trò quan trọng trong lịch sử phát triển của nhân loại. Từ khi được phát hiện, kim loại đã được khai thác và ứng dụng trọng mọi mặt của cuộc sống. Để biết được câu trả lời của các bạn là đúng hay sai, đồng thời tìm hiểu thêm về tính chất vật lí, tính chất hóa học của kim loại, chúng ta cùng vào bài học ngày hôm nay Bài 15 – Tính chất chung của kim loại.
- HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1. Tính chất vật lí của kim loại
- Mục tiêu: HStrình bày được các tính chất vật lí chung của kim loại; xác định được ứng dụng của các kim loại trong đời sống dựa trên tính chất vật lí nào.
- Nội dung: HS đọc các thông tin trong SGK trang 77 – 79 và thực hiện yêu cầu của GV.
- Sản phẩm: Câu trả lời của HS về tính chất vật lí chung của kim loại; nêu được các ứng dụng của kim loại tương ứng với tính chất vật lí nào.
- Tổ chức hoạt động:
|
HOẠT ĐỘNG CỦA GV - HS |
DỰ KIẾN SẢN PHẨM |
||||
|
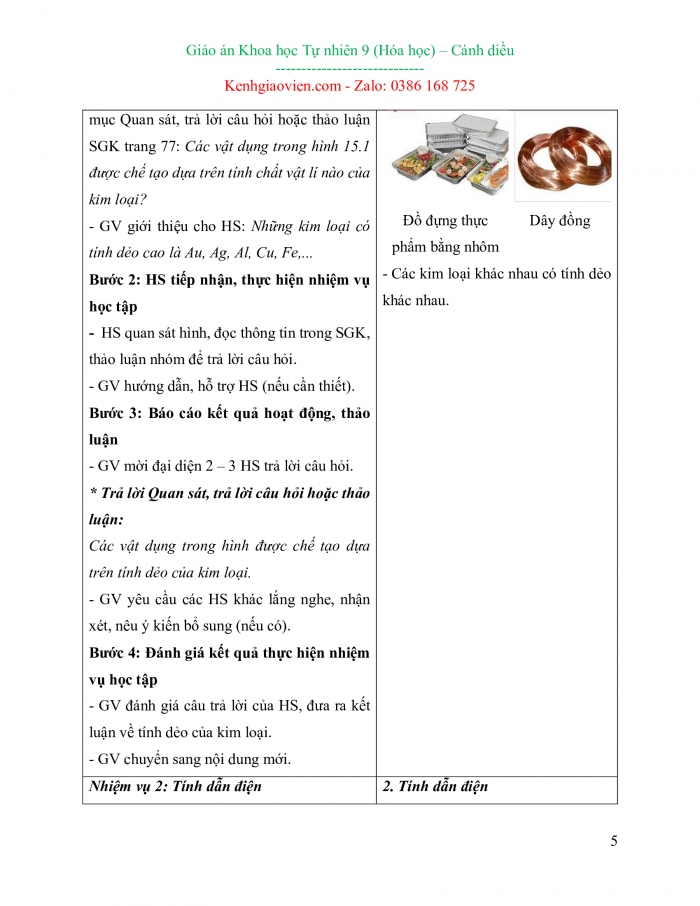
Nhiệm vụ 1: Tính dẻo Bước 1: GV chuyển giao nhiệm vụ học tập - GV tổ chức cho HS quan sát Hình 15.1.
- GV yêu cầu HS đọc thông tin trong SGK, thảo luận nhóm đôi để trả lời câu hỏi trong mục Quan sát, trả lời câu hỏi hoặc thảo luận SGK trang 77: Các vật dụng trong hình 15.1 được chế tạo dựa trên tính chất vật lí nào của kim loại? - GV giới thiệu cho HS: Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, Fe,... Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, đọc thông tin trong SGK, thảo luận nhóm để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời Quan sát, trả lời câu hỏi hoặc thảo luận: Các vật dụng trong hình được chế tạo dựa trên tính dẻo của kim loại. - GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về tính dẻo của kim loại. - GV chuyển sang nội dung mới. |
I. Tính chất vật lí của kim loại 1. Tính dẻo - Kim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng. - Ứng dụng: Dùng để tạo các đồ vật như hộp đựng thức ăn bằng nhôm, dây đồng, giấy nhôm bọc thực phẩm,…. - Ví dụ:
- Các kim loại khác nhau có tính dẻo khác nhau.
|
||||
|
Nhiệm vụ 2: Tính dẫn điện Bước 1: GV chuyển giao nhiệm vụ học tập - GV tổ chức cho HS quan sát Hình 15.2.
Hình 15.2. Thí nghiệm về tính dẫn điện của kim loại - GV yêu cầu HS đọc thông tin trong SGK, thảo luận nhóm đôi để trả lời câu hỏi trong mục Quan sát, trả lời câu hỏi hoặc thảo luận SGK trang 78: Quan sát hình 15.2, nêu hiện tượng trước và sau khi chạm hai đầu dây dẫn A và B vào mẩu kim loại. Giải thích. - GV cho HS quan sát Hình 15.3.
Hình 15.3. Dây cáp điện được làm từ nhôm - GV mở rộng kiến thức cho HS: Thực tế, người ta chủ yếu sử dụng Cu và Al làm dây dẫn điện vì chúng dẫn điện tốt và có giá thành rẻ hơn so với Ag, Au. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, đọc thông tin trong SGK, thảo luận nhóm để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời Quan sát, trả lời câu hỏi hoặc thảo luận: + Trước khi chạm hai đầu dây dẫn vào mẩu kim loại, đèn không sáng. + Sau khi chạm hai đầu dây dẫn vào mẩu kim loại, đèn sáng. - GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về tính dẫn điện của kim loại. - GV chuyển sang nội dung mới. |
2. Tính dẫn điện - Kim loại có tính dẫn điện. - Các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al,… - Ví dụ:
Đồng, nhôm thường được sử dụng làm dây dẫn điện
|
||||
|
Nhiệm vụ 3: Tính dẫn nhiệt Bước 1: GV chuyển giao nhiệm vụ học tập - GV tổ chức cho HS quan sát Hình 15.4.
Hình 15.4. Hơ nóng sợi dây nhôm - GV yêu cầu HS đọc thông tin trong SGK kết hợp với liên hệ thực tế, thảo luận nhóm đôi để trả lời câu hỏi: Em có cảm thấy nóng tại vị trí cầm dây nhôm không? Từ đó, em có kết luận gì về tính chất của dây nhôm trong thí nghiệm? - GV yêu cầu HS suy nghĩ, vận dụng kiến thức đã học để trả lời câu hỏi phần Luyện tập 1 SGK trang 78: Dự đoán khả năng dẫn nhiệt của các kim loại Cu, Al, Fe và Ag theo chiều giảm dần. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, đọc thông tin trong SGK, thảo luận nhóm để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV: + Khi hơ nóng một sợi dây nhôm trên ngọn lửa đèn cồn, mặc dù tay cầm một đầu dây nhôm không tiếp xúc với ngọn lửa nhưng ta vẫn cảm nhận có hiện tượng nóng lên. + Như vậy, dây nhôm đã truyền nhiệt từ ngọn lửa tới tay người. Dây nhôm có khả năng dẫn nhiệt. * Trả lời Luyện tập 1: + Vì các kim loại dẫn điện tốt thường cũng dẫn nhiệt tốt nên ta có thể sắp xếp các kim loại đã cho theo chiều giảm dần về khả năng dẫn nhiệt như sau: Ag, Cu, Al, Fe. - GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về tính dẫn nhiệt của kim loại. - GV chuyển sang nội dung mới. |
3. Tính dẫn nhiệt - Kim loại có tính dẫn nhiệt. - Các kim loại khác nhau thường có khả năng dẫn nhiệt khác nhau. Kim loại dẫn điện tốt thường cũng dẫn nhiệt tốt. - Ứng dụng: Một số kim loại được dùng để chế tạo dụng cụ nấu ăn. - Ví dụ:
Nhôm thường được dùng để làm xoong vì khả năng dẫn nhiệt tốt
|
||||
|
Nhiệm vụ 4: Ánh kim Bước 1: GV chuyển giao nhiệm vụ học tập - GV tổ chức cho HS quan sát hình sau.
- GV yêu cầu HS trả lời câu hỏi: Em có nhận xét gì về bề ngoài của trang sức được làm từ vàng trong hình (bề mặt của trang sức có sáng lấp lánh hay không,…)? - GV yêu cầu HS quan sát Hình 15.5.
Hình 15.5. Vòng tay được làm từ kim loại vàng, bạc - GV yêu cầu HS suy nghĩ, vận dụng kiến thức đã học để trả lời câu hỏi phần Quan sát, trả lời câu hỏi hoặc thảo luận SGK trang 79: Em hãy cho biết màu sắc và vẻ sáng của đồ trang sức trong Hình 15.5. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, đọc thông tin trong SGK, thảo luận nhóm để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV: + Bề mặt trang sức trong hình có vẻ sáng lấp lánh. * Trả lời Quan sát, trả lời câu hỏi hoặc thảo luận: + Màu sắc của trang sức trong hình có màu giống với màu của kim loại tạo nên chúng. + Các trang sức trong hình đều có vẻ sáng lấp lánh. - GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về tính ánh kim của kim loại. - GV chuyển sang nội dung mới. |
4. Ánh kim - Kim loại có tính ánh kim. - Ứng dụng: Dùng làm đồ trang sức và các vật dụng trang trí khác. - Ví dụ:
|
||||
|
Nhiệm vụ 5: Một số tính chất vật lí khác của kim loại Bước 1: GV chuyển giao nhiệm vụ học tập - GV tổ chức cho HS quan sát hình sau.
- GV chia lớp thành 3 nhóm, yêu cầu HS đọc thông tin trong SGK trang 79, thảo luận nhóm để trả lời câu hỏi: + Nhóm 1: Để so sánh xem kim loại nào nặng hay nhẹ hơn kim loại khác, ta sử dụng tính chất vật lí nào? Dựa vào bảng trên, hãy cho biết Na nặng hơn kim loại nào? + Nhóm 2: Theo em, nhiệt độ nóng chảy là gì? Cho các kim loại gồm K, Na, Rb. Tại 64oC, kim loại nào bị nóng chảy? + Nhóm 3: Dựa vào bảng trên, hãy cho biết các kim loại khác nhau có độ cứng giống nhau hay không? Vật chất được dùng để làm chuẩn cho độ cứng của các kim loại trong bảng trên là gì? - GV tổ chức cho HS đọc thông tin trong mục Em có biết SGK trang 79 để mở rộng kiến thức. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát hình, đọc thông tin trong SGK, thảo luận nhóm để trả lời câu hỏi. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết). Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 – 3 HS trả lời câu hỏi. * Trả lời câu hỏi của GV: + Nhóm 1: Để so sánh kim loại này nặng hay nhẹ hơn kim loại khác, ta sử dụng khối lượng riêng. Na nặng hơn Li và K. + Nhóm 2: Nhiệt độ nóng chảy của một kim loại là nhiệt độ mà tại đó kim loại chuyển từ thể rắn sang thể lỏng. Tại 64oC, K và Rb bị nóng chảy. + Nhóm 3: Các kim loại khác nhau có tính cứng khác nhau. Kim cương được dùng làm chuẩn trong thang độ cứng trong bảng. - GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về một số tính chất vật lí khác của kim loại. - GV chuyển sang nội dung mới. |
5. Một số tính chất vật lí khác của kim loại * Khối lượng riêng - Để biết kim loại này nặng hay nhẹ hơn so với kim loại khác, người ta so sánh giá trị khối lượng riêng của chúng. * Nhiệt độ nóng chảy - Nhiệt độ nóng chảy của một kim loại là nhiệt độ mà tại đó kim loại chuyển từ thể rắn sang thể lỏng. * Tính cứng - Các kim loại khác nhau có tính cứng khác nhau. - Các kim loại mềm (K, Na,…) có thể dùng dao cắt được. Kim loại cứng nhất là Cr.
|
Hoạt động 2. Tính chất hóa học
- Mục tiêu: HS nêu được các tính chất hóa học chung của kim loại, viết được phương trình hóa học tương ứng; vận dụng được kiến thức đã học để giải thích được một số hiện tượng trong cuộc sống.
- Nội dung: HS quan sát video minh họa phản ứng hóa học của kim loại, đọc thông tin trong SGK trang 80 – 82 và trả lời các câu hỏi của GV.
- Sản phẩm: Câu trả lời của HS về tính chất hóa học chung của kim loại, vận dụng kiến thức đã học giải thích các hiện tượng trong cuộc sống.
- Tổ chức hoạt động:
|
HOẠT ĐỘNG CỦA GV - HS |
DỰ KIẾN SẢN PHẨM |
|
Nhiệm vụ 1: Phản ứng của kim loại với phi kim Bước 1 : GV chuyển giao nhiệm vụ học tập - GV chia lớp thành 2 nhóm: + Nhóm 1: Quan sát video minh họa phản ứng của magnesium (0:37-1:00) với khí oxygen. + Nhóm 2: Quan sát video minh họa phản ứng của natri (0:23-1:36) với khí chlorine, sắt (0:14-0:50) với lưu huỳnh. - GV yêu cầu mỗi nhóm dựa vào thông tin trong video và thông tin trong SGK, thảo luận để hoàn thành câu hỏi trong Phiếu bài tập và câu hỏi phần Quan sát, trả lời câu hỏi hoặc thảo luận, Luyện tập 2 (trong Phiếu bài tập). Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát video, đọc thông tin trong bài để thực hiện yêu cầu của GV. - HS hai nhóm chia sẻ chéo thông tin tìm hiểu được thông qua video, nội dung trong SGK. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết); ghi lại những HS tích cực, những HS chưa tích cực để điều chỉnh. Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 - 3 HS xung phong trả lời. Các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có) (Đính kèm bên dưới hoạt động). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về tính chất hóa học của kim loại khi tác dụng với phi kim: + Kim loại tác dụng với khí oxygen tạo oxide. + Kim loại tác dụng với phi kim khác tạo muối. - GV chuyển sang nội dung mới. |
II. Tính chất hóa học 1. Phản ứng của kim loại với phi kim * Tác dụng với oxygen - Hầu hết các kim loại phản ứng với oxygen tạo thành oxide. Ví dụ: 2Mg + O2 2MgO * Tác dụng với phi kim khác - Nhiều kim loại phản ứng với các phi kim khác tạo thành muối. Ví dụ: Fe + S FeS
|
|
Nhiệm vụ 2: Phản ứng của kim loại với dung dịch acid Bước 1 : GV chuyển giao nhiệm vụ học tập - GV yêu cầu HS dựa vào kiến thức đã học trong Bài 8: Acid (Khoa học Tự nhiên 8, SGK trang 47) để trả lời câu hỏi: Hãy cho biết sản phẩm khi cho kim loại phản ứng với dung dịch hydrochloric acid. Viết phương trình minh họa. - GV mở rộng kiến thức cho HS về các kim loại không tác dụng với dung dịch acid. - GV nêu câu hỏi mở rộng: Viết phương trình hóa học của phản ứng xảy ra khi cho kim loại sắt vào dung dịch hydrochloric acid. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS nhớ lại kiến thức, đọc thông tin trong bài để thực hiện yêu cầu của GV. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết); ghi lại những HS tích cực, những HS chưa tích cực để điều chỉnh. Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 - 3 HS xung phong trả lời. Các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). * Trả lời câu hỏi của GV: + Các kim loại (trừ Cu, Ag, Au,…) phản ứng với dung dịch HCl tạo thành muối và khí hydrogen. Ví dụ: Mg + 2HCl → MgCl2 + H2 + Sắt phản ứng với dung dịch HCl theo phương trình: Fe + 2HCl → FeCl2 + H2 Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV nhận xét, đánh giá câu trả lời của HS; đưa ra kết luận về khả năng tác dụng với dung dịch acid của các kim loại. - GV chuyển sang nội dung mới. |
2. Phản ứng của kim loại với dung dịch acid - Nhiều kim loại phản ứng với dung dịch acid (HCl, H2SO4 loãng,…) tạo thành muối và giải phóng khí H2. Ví dụ: 2Al + 6HCl → 2AlCl3 + 3H2↑ - Một số kim loại Cu, Ag, Au,… không tác dụng với dung dịch acid (HCl, H2SO4 loãng,…).
|
|
Nhiệm vụ 3: Phản ứng của kim loại với dung dịch muối Bước 1 : GV chuyển giao nhiệm vụ học tập - GV yêu cầu HS dựa vào kiến thức đã học trong Bài 12: Muối (Khoa học Tự nhiên 8, SGK trang 62) để trả lời câu hỏi: Hãy cho biết sản phẩm khi cho kim loại phản ứng với dung dịch muối. Viết phương trình minh họa. - GV mở rộng kiến thức cho HS về nguyên lí của phản ứng giữa kim loại với dung dịch muối dựa vào mức độ hoạt động hóa học của kim loại. - GV tổ chức cho HS xem video (0:19-1:23) minh họa phản ứng giữa Fe và dung dịch muối CuSO4. - GV yêu cầu HS dựa vào nội dung video, suy nghĩ trả lời câu hỏi mục Quan sát, trả lời câu hỏi hoặc thảo luận SGK trang 81: Cho biết trước, trong và sau một thời gian phản ứng, màu của dung dịch CuSO4 và đinh sắt thay đổi như thế nào. Giải thích. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS nhớ lại kiến thức, đọc thông tin trong bài để thực hiện yêu cầu của GV. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết); ghi lại những HS tích cực, những HS chưa tích cực để điều chỉnh. Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 - 3 HS xung phong trả lời. Các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có): * Trả lời câu hỏi của GV: Sản phẩm của phản ứng giữa kim loại và dung dịch muối thường là muối mới và kim loại mới. Ví dụ: Zn + FeSO4 → ZnSO4 + Fe * Trả lời Quan sát, trả lời câu hỏi hoặc thảo luận: + Màu sắc của dung dịch CuSO4 nhạt dần; bên ngoài đinh sắt có một lớp kim loại màu cam đỏ bám vào. + Hiện tượng trên xảy ra là do trong quá trình phản ứng sinh ra Cu, lượng Cu mới tạo thành bám vào đinh sắt theo phương trình: Fe + CuSO4 → FeSO4 + Cu↓ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV nhận xét, đánh giá câu trả lời của HS; đưa ra kết luận về khả năng tác dụng với dung dịch muối của các kim loại. - GV chuyển sang nội dung mới. |
3. Phản ứng của kim loại với dung dịch muối - Kim loại hoạt động hóa học mạnh hơn (trừ các kim loại K, Na, Ca,…) có thể đẩy được kim loại có mức độ hoạt động hóa học yếu hơn ra khỏi dung dịch muối tạo thành muối mới và kim loại mới. Ví dụ: Fe + CuSO4 → FeSO4 + Cu
|
|
Nhiệm vụ 4: Phản ứng với nước Bước 1 : GV chuyển giao nhiệm vụ học tập - GV tổ chức cho HS quan sát video (0:00-0:12) minh họa phản ứng của natri với nước. - GV yêu cầu HS suy nghĩ, dự đoán sản phẩm của phản ứng trong video. - GV cung cấp cho HS kiến thức nâng cao về các kim loại như Zn, Fe và khả năng phản ứng với nước của chúng. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS quan sát video, đọc thông tin trong bài để thực hiện từng yêu cầu. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết); ghi lại những HS tích cực, những HS chưa tích cực để điều chỉnh. Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 - 3 HS xung phong trả lời. Các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). * Trả lời câu hỏi của GV: Sản phẩm của phản ứng trong video là NaOH và H2 Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về khả năng phản ứng với nước của các kim loại. - GV chuyển sang nội dung mới. |
4. Phản ứng với nước - Một số kim loại như K, Na, Ca,… tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí H2. Ví dụ: 2Na + 2H2O → 2NaOH + H2 - Một số kim loại như Zn và Fe tác dụng được với hơi nước ở nhiệt độ cao tạo thành oxide và khí H2. Ví dụ: Zn + H2O ZnO + H2
|
|
PHIẾU BÀI TẬP (NHÓM 1) KIM LOẠI TÁC DỤNG VỚI OXYGEN Họ và tên: Lớp: Câu 1: Nêu hiện tượng khi cho magnesium cháy trong khí oxygen. Viết phương trình hóa học minh họa. ….…………………………………………………………………………………… Câu 2: Em có kết luận gì về phản ứng của kim loại với khí oxygen? ….……………………………………………………………… Câu 3: Viết các phương trình hóa học minh họa một số tính chất hóa học của kim loại mà em đã biết. ….…………………………………………………………………………………… Câu 4: Tại sao đồ vật làm bằng kim loại để lâu trong không khí thì không còn vẻ ánh kim? ….……………………………………………………………………………… |
Gợi ý trả lời
|
PHIẾU BÀI TẬP (NHÓM 1) KIM LOẠI TÁC DỤNG VỚI OXYGEN Họ và tên: Lớp: Câu 1: Nêu hiện tượng khi cho magnesium cháy trong khí oxygen. Viết phương trình hóa học minh họa. Magnesium cháy trong khí khí oxygen phát ra ánh sáng chói theo phản ứng: 2Mg + O2 2MgO Câu 2: Em có kết luận gì về phản ứng của kim loại với khí oxygen? Hầu hết các kim loại phản ứng với khí oxygen tạo thành oxide. Câu 3: Viết các phương trình hóa học minh họa một số tính chất hóa học của kim loại mà em đã biết. - Phương trình hóa học của kẽm với khí oxygen: 2Zn + O2 2ZnO - Phương trình hóa học của đồng với khí oxygen: 2Cu + O2 2CuO Câu 4: Tại sao đồ vật làm bằng kim loại để lâu trong không khí thì không còn vẻ ánh kim? Các đồ vật làm bằng kim loại để lâu trong không khí sẽ tác dụng với khí oxygen trong không khí tạo thành oxide, làm mất ánh kim. |
|
PHIẾU BÀI TẬP (NHÓM 2) KIM LOẠI TÁC DỤNG VỚI PHI KIM KHÁC Họ và tên: Lớp: Câu 1: Nêu hiện tượng khi cho natri đã đun nóng chảy vào bình đựng khí chlorine. Viết phương trình hóa học minh họa. ….………………………………………………………………… Câu 2: Nêu hiện tượng khi cho bột sắt phản ứng với lưu huỳnh. Viết phương trình hóa học minh họa. ….…………………………… Câu 3: Em có kết luận gì về phản ứng của kim loại với phi kim (trừ oxygen)? ….………………………………………………………………………… Câu 4: Viết phương trình hóa học của các phản ứng giữa kim loại Mg, Zn với phi kim S. ….…………………………………………………………………………… Câu 5: Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì có thể dùng bột lưu huỳnh rắc lên thủy ngân vì thủy ngân tác dụng với lưu huỳnh tạo thành chất mới không bay hơi và dễ thu gom. Viết phương trình hóa học của phản ứng xảy ra. ….……………………………………………………………………………… |
Gợi ý trả lời
|
PHIẾU BÀI TẬP 2 (NHÓM 2) KIM LOẠI TÁC DỤNG VỚI PHI KIM KHÁC Họ và tên: Lớp: Câu 1: Nêu hiện tượng khi cho natri đã đun nóng chảy vào bình đựng khí chlorine. Viết phương trình hóa học minh họa. Natri cháy trong khí chlorine (màu vàng lục) tạo thành tinh thể muối ăn màu trắng theo phản ứng: 2Na + Cl2 2NaCl Câu 2: Nêu hiện tượng khi cho bột sắt phản ứng với lưu huỳnh. Viết phương trình hóa học minh họa. Hỗn hợp sắt và lưu huỳnh cháy sáng và bắt đầu chuyển thành hợp chất màu đen theo phản ứng: Fe + S FeS Câu 3: Em có kết luận gì về phản ứng của kim loại với phi kim (trừ oxygen)? Kim loại có thể tác dụng với nhiều phi kim tạo thành muối. Câu 4: Viết phương trình hóa học của các phản ứng giữa kim loại Mg, Zn với phi kim S. - Phương trình hóa học của Mg với S: Mg + S MgS - Phương trình hóa học của Zn với S: Zn + S ZnS Câu 5: Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì có thể dùng bột lưu huỳnh rắc lên thủy ngân vì thủy ngân tác dụng với lưu huỳnh tạo thành chất mới không bay hơi và dễ thu gom. Viết phương trình hóa học của phản ứng xảy ra. - Phương trình hóa học của Hg với S: Hg + S → HgS |
Hoạt động 3. Sự khác biệt về tính chất của một số kim loại
- Mục tiêu: HS nêu được sự khác biệt về tính chất của một số kim loại; vận dụng được sự khác biệt đó để ứng dụng trong cuộc sống.
- Nội dung: HS đọc các thông tin trong SGK trang 82 và thực hiện yêu cầu của GV.
- Sản phẩm: Câu trả lời của HS về sự khác biệt về tính chất của một số kim loại, vận dụng sự khác biệt đó để ứng dụng trong cuộc sống.
- Tổ chức hoạt động:
|
HOẠT ĐỘNG CỦA GV - HS |
DỰ KIẾN SẢN PHẨM |
||||||||||||||||
|
Bước 1 : GV chuyển giao nhiệm vụ học tập - GV yêu cầu HS đọc thông tin trong SGK trang 82, thảo luận nhóm đôi để trả lời câu hỏi mục Quan sát, trả lời câu hỏi hoặc thảo luận: So sánh sự khác biệt về tính chất vật lí, tính chất hóa học và một số ứng dụng quan trọng của nhôm, sắt, vàng. Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập - HS đọc thông tin trong bài để thực hiện yêu cầu của GV. - GV hướng dẫn, hỗ trợ HS (nếu cần thiết); ghi lại những HS tích cực, những HS chưa tích cực để điều chỉnh. Bước 3: Báo cáo kết quả hoạt động, thảo luận - GV mời đại diện 2 - 3 HS xung phong trả lời. Các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có). Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập - GV đánh giá câu trả lời của HS, đưa ra kết luận về sự khác biệt về tính chất vật lí của một số kim loại. - GV chuyển sang nội dung luyện tập. |
III. Sự khác biệt về tính chất của một số kim loại - Nhôm, sắt, vàng,… có sự khác biệt về tính chất vật lí và tính chất hóa học. Do vậy, chúng được sử dụng với những mục đích khác nhau:
|
- HOẠT ĐỘNG LUYỆN TẬP
- Mục tiêu: Củng cố kiến thức, giúp HS nêu được các tính chất vật lí, tính chất hóa học chung của kim loại; vận dụng các kiến thức đã học để giải quyết một số vấn đề trong thực tiễn.
- Nội dung: HS trả lời các câu hỏi trắc nghiệm liên quan đến nội dung bài học, câu hỏi Luyện tập 3, 4.
- Sản phẩm:Câu trả lời của HS về các tính chất vật lí, tính chất hóa học chung của kim loại; vận dụng các kiến thức đã học để giải quyết một số vấn đề trong thực tiễn.
- Tổ chức thực hiện
Nhiệm vụ 1: Trả lời câu hỏi trắc nghiệm
Bước 1: GV chuyển giao nhiệm vụ học tập
GV yêu cầu HS dựa vào kiến thức đã học để trả lời các câu hỏi trắc nghiệm:
Câu 1. Đâu không phải là tính chất vật lí chung của kim loại?
- Tính dẻo. B. Tính dẫn điện, dẫn nhiệt.
- Ánh kim. D. Mạ vàng.
Câu 2. Oxide được tạo thành khi cho kim loại phản ứng với
- oxygen. B. hydrogen. C. chlorine. D. sulfur.
Câu 3. Vì sao đồ bằng nhôm thường bền trong không khí?
- Vì khí oxygen có tính ăn mòn cao, làm thay đổi tính chất vật lí của nhôm.
- Vì nhôm tác dụng với khí oxygen trong không khí tạo lớp màng oxide bền vững.
- Vì trong không khí có acid, làm nhôm chuyển thành muối.
- Vì hàm lượng nhôm trong đồ dùng ít nên khó bị ăn mòn.
Câu 4. Sản phẩm khi cho kim loại tác dụng với phi kim (trừ oxygen) là
- acid. B. base. C. muối. D. oxide.
Câu 5. Kim loại tác dụng với nước không tạo hydroxide là
- Na. B. K. C. Ca. D. Fe.
Câu 6. Bạn A muốn chọn một kim loại để thực hiện phản ứng giữa kim loại với dung dịch acid, A có thể chọn kim loại
- Cu. B. Al. C. Ag. D. Au.
Câu 7. Cho 0,01 mol Fe phản ứng vừa đủ với dung dịch CuSO4. Sau phản ứng, khối lượng muối thu được là
- 1,52 gam. B. 1,6 gam. C. 0,56 gam. D. 0,64 gam.
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS tiếp nhận, thực hiện làm bài tập trắc nghiệm theo yêu cầu.
- GV quan sát và hỗ trợ, hướng dẫn.
Bước 3 : Báo cáo kết quả hoạt động, thảo luận
- GV mời đại diện 2 – 3 HS trình bày kết quả:
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
|
D |
A |
B |
C |
D |
B |
A |
- GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có).
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV nhận xét, đánh giá và chốt đáp án.
- GV chuyển sang nội dung mới.
Nhiệm vụ 2: Trả lời câu hỏi Luyện tập 3, 4
Bước 1: GV chuyển giao nhiệm vụ học tập
GV yêu cầu HS dựa vào kiến thức đã học để trả lời các câu hỏi Luyện tập 3, 4:
Luyện tập 3. Viết phương trình hóa học của phản ứng xảy ra khi cho Zn tác dụng với O2, dung dịch H2SO4 loãng và dung dịch muối CuSO4.
Luyện tập 4. Giải thích vì sao thực phẩm có vị chua không nên đựng trong đồ dùng bằng kim loại mà nên đựng trong đồ dùng bằng thủy tinh, sành hoặc sứ.
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS tiếp nhận, thực hiện làm bài tập theo yêu cầu.
- GV quan sát và hỗ trợ, hướng dẫn.
Bước 3 : Báo cáo kết quả hoạt động, thảo luận
- GV mời đại diện 2 – 3 HS trình bày kết quả:
Luyện tập 3.
+ Zn tác dụng với O2: 2Zn + O2 2ZnO
+ Zn tác dụng với dung dịch H2SO4 loãng: Zn + H2SO4 → ZnSO4 + H2
+ Zn tác dụng với dung dịch muối CuSO4: Zn + CuSO4 → ZnSO4 + Cu
Luyện tập 4. Các thực phẩm có vị chua thường có tính acid. Khi đựng các loại thực phẩm này trong đồ dùng bằng kim loại, acid có trong thực phẩm sẽ phản ứng với kim loại, gây hỏng đồ đựng. Các đồ dùng bằng thủy tinh, sành hoặc sứ không xảy ra phản ứng này nên có thể sử dụng chúng để đựng thực phẩm có vị chua.
- GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có).
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV nhận xét, đánh giá và chốt đáp án.
- GV chuyển sang nội dung vận dụng.
- HOẠT ĐỘNG VẬNDỤNG
- Mục tiêu: HS tìm hiểu và nêu được quá trình con người phát hiện ra đồng.
- Nội dung: HS trả lời các câu hỏi phần Tìm hiểu thêmSGK trang 82.
- Sản phẩm:HS tìm hiểu được quá trình con người phát hiện ra đồng.
- Tổ chức thực hiện
Bước 1: GV chuyển giao nhiệm vụ học tập
GV yêu cầu HS làm việc cá nhân, đọc các câu hỏi phần Tìm hiểu thêm SGK trang 82.
Tìm hiểu thêm. Vào khoảng thiên niên kỉ thứ IV trước Công nguyên, người nguyên thủy đã phát hiện ra một loại vật liệu mới để chế tạo công cụ và vũ khí thay thế cho đồ đá, đó là đồng. Em hãy tìm hiểu quá trình con người phát hiện ra đồng
Bước 2: HS tiếp nhận, thực hiện nhiệm vụ học tập
- HS nhớ lại các kiến thức đã học để trả lời câu hỏi.
- GV hướng dẫn, hỗ trợ HS (nếu cần thiết).
Bước 3 : Báo cáo kết quả hoạt động, thảo luận
- GV mời đại diện 2 – 3 HS xung phong trả lời:
Tìm hiểu thêm. Quá trình con người phát hiện ra đồng:
Vào khoảng thiên niên kỉ thứ IV TCN, người nguyên thủy đã phát hiện ra một loại nguyên liệu mới để chế tạo công cụ và vũ khí thay thế cho đồ đá. Đó là đồng.
- Vào khoảng 3500 năm TCN: Người Tây Á và Ai Cập đã biết dùng đồng đỏ để chế tác công cụ lao động.
- Khoảng 200 năm TCN: Cư dân nhiều nơi trên thế giới đã biết sử dụng đồng thau.
Công cụ, vũ khí bằng đồng nguyên chất
(I-xra-en, thiên niên kỉ IV TCN)
- GV yêu cầu các HS khác lắng nghe, nhận xét, nêu ý kiến bổ sung (nếu có).
Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập
- GV nhận xét, đánh giá, góp ý về câu trả lời của nhóm HS và tổng kết lại kiến thức về tính chất của kim loại.
- GV kết thúc tiết học.
HƯỚNG DẪN VỀ NHÀ
- Ôn lại kiến thức đã học.
- Đọc và tìm hiểu trước nội dung kiến thức Bài 16 – Dãy hoạt động hóa học.
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Xem thêm giáo án khác
GIÁO ÁN TỰ NHIÊN 9 CÁNH DIỀU
Giáo án Toán 9 mới năm 2024 cánh diều
Bài giảng điện tử toán 9 cánh diều
Giáo án Hình học 9 mới năm 2024 cánh diều
Bài giảng điện tử Hình học 9 cánh diều
Giáo án dạy thêm Toán 9 mới năm 2024 cánh diều
Bài giảng điện tử dạy thêm Toán 9 cánh diều
Giáo án Đại số 9 mới năm 2024 cánh diều
Bài giảng điện tử Đại số 9 cánh diều
Giáo án Khoa học tự nhiên 9 mới năm 2024 cánh diều
Bài giảng điện tử Khoa học tự nhiên 9 cánh diều
Giáo án Vật lí 9 mới năm 2024 cánh diều
Bài giảng điện tử Vật lí 9 cánh diều
Giáo án Sinh học 9 mới năm 2024 cánh diều
Bài giảng điện tử Sinh học 9 cánh diều
Giáo án Tin học 9 mới năm 2024 cánh diều
Bài giảng điện tử Tin học 9 cánh diều
Giáo án Công nghệ 9 - trồng cây ăn quả mới năm 2024 cánh diều
Bài giảng điện tử Công nghệ (trồng cây ăn quả) 9 cánh diều
Giáo án Công nghệ 9 - Lắp đặt mạch điện mới năm 2024 cánh diều
Bài giảng điện tử Công nghệ (Lắp đặt mạch điện) 9 cánh diều
Giáo án Công nghệ 9 - Chế biến thực phẩm mới năm 2024 cánh diều
Bài giảng điện tử Công nghệ 9 - Chế biến thực phẩm cánh diều
Giáo án Công nghệ 9 - Định hướng nghề nghiệp mới năm 2024 cánh diều
Bài giảng điện tử Công nghệ (Định hướng nghề nghiệp) 9 cánh diều
GIÁO ÁN XÃ HỘI 9 CÁNH DIỀU
Giáo án Ngữ văn 9 mới năm 2024 cánh diều
Bài giảng điện tử Ngữ văn 9 cánh diều
Giáo án dạy thêm Ngữ văn 9 mới năm 2024 cánh diều
Bài giảng điện tử dạy thêm Ngữ văn 9 cánh diều
Giáo án Lịch sử và địa lí 9 mới năm 2024 cánh diều
Bài giảng điện tử Lịch sử và địa lí 9 cánh diều
Giáo án Lịch sử 9 mới năm 2024 cánh diều
Bài giảng điện tử Lịch sử 9 cánh diều
Giáo án Địa lí 9 mới năm 2024 cánh diều
Bài giảng điện tử Địa lí 9 cánh diều
Giáo án Công dân 9 mới năm 2024 cánh diều
Bài giảng điện tử Giáo dục công dân 9 cánh diều
GIÁO ÁN 9 CÁC MÔN CÒN LẠI CÁNH DIỀU
Giáo án Mĩ thuật 9 mới năm 2024 cánh diều
Bài giảng điện tử mĩ thuật 9 cánh diều
Giáo án Âm nhạc 9 mới năm 2024 cánh diều
Bài giảng điện tử Âm nhạc 9 cánh diều
Giáo án Thể dục 9 mới năm 2024 cánh diều
Giáo án Hoạt động trải nghiệm hướng nghiệp 9 mới năm 2024 cánh diều
Bài giảng điện tử Hoạt động trải nghiệm hướng nghiệp 9 cánh diều
GIÁO ÁN CÁC BỘ SÁCH KHÁC
Giáo án tất cả các môn lớp 9 kết nối tri thức
Giáo án tất cả các môn lớp 9 chân trời sáng tạo
