Bài giảng điện tử khoa học tự nhiên 8 cánh diều
Bài giảng Powerpoint, bài giảng điện tử khoa học tự nhiên 8 chương trình mới sách cánh diều. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Giáo án có nhiều hình ảnh đẹp, tư liệu sinh động. Chắc chắn bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng. Powerpoint khoa học tự nhiên 8 cánh diều.
Click vào ảnh dưới đây để xem giáo án rõ










Đầy đủ Giáo án khoa học tự nhiên THCS cánh diều
- Bài giảng điện tử Khoa học tự nhiên 9 cánh diều
- Giáo án Khoa học tự nhiên 9 mới năm 2024 cánh diều
- Giáo án khoa học tự nhiên 8 mới năm 2023 cánh diều
- Bài giảng điện tử khoa học tự nhiên 8 cánh diều
- Bài giảng Powerpoint khoa học tự nhiên 7 cánh diều
- Tải GA word khoa học tự nhiên 7 cánh diều
- Tải bài giảng điện tử Khoa học tự nhiên 6 cánh diều
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
- Quan sát các hình ảnh 4.1, 4.2 (SGK tr.27) và trả lời câu hỏi
- Hình 4.1. Lâu đài bằng gạch
- Hình 4.2. Lâu đài bằng cát
KHỞI ĐỘNG
Nếu yêu cầu đếm số lượng viên gạch để xây bức tường của lâu đài (hình 4.1) và đếm số lượng hạt cát để xây bức tường của lâu đài bằng cát (hình 4.2), yêu cầu nào có thể thực hiện được ? Vì sao ?
BÀI 4. MOL VÀ TỈ KHỐI CHẤT KHÍ
NỘI DUNG BÀI HỌC
- KHÁI NIỆM MOL
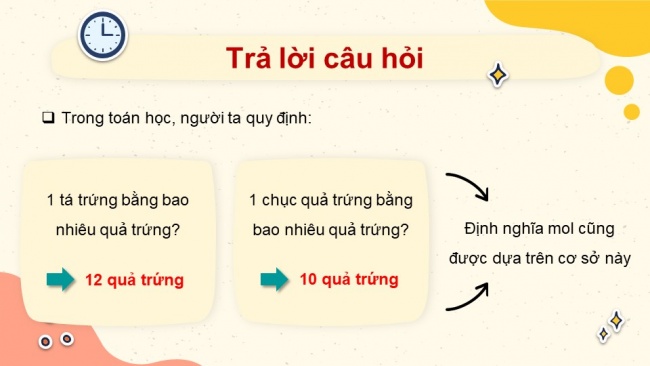
- Trong toán học, người ta quy định:
- 1 tá trứng bằng bao nhiêu quả trứng?
=> 12 quả trứng
1 chục quả trứng bằng bao nhiêu quả trứng?
Định nghĩa mol cũng được dựa trên cơ sở này
Khái niệm
Mol là lượng chất có chứa 6,022 1023 hạt vi mô (nguyên tử, phân tử,…) của chất đó.
Số 6,0221023 được gọi là số Avogadro, được kí hiệu là NA
Mở rộng kiến thức
- Giá trị số Avogadro vô cùng lớn.
- Nếu một máy đếm các nguyên tử với tốc độ 10 triệu nguyên tử mỗi giây sẽ mất khoảng 2 tỉ năm để đếm hết các nguyên tử trong một mol.
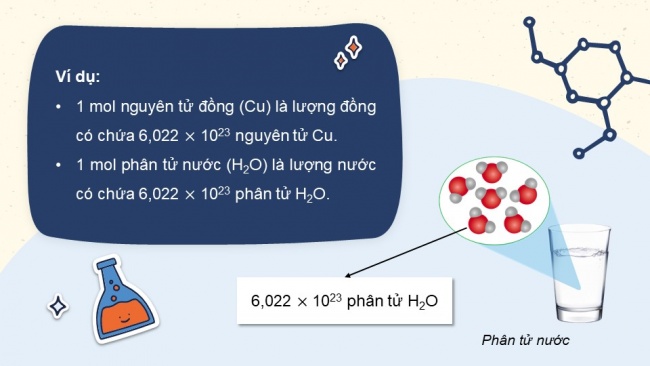
Ví dụ:
- 1 mol nguyên tử đồng (Cu) là lượng đồng có chứa 6,022 1023 nguyên tử Cu.
- 1 mol phân tử nước (H2O) là lượng nước có chứa 6,022 1023 phân tử H2
- 6,022 1023 phân tử H2O
Bài tập
Câu hỏi 1 (SGK 27). Xác định số nguyên tử có trong:
- 2 mol nguyên tử nhôm (aluminium)
- 1,5 mol nguyên tử carbon
- 2 mol nguyên tử nhôm là lượng nhôm có chứa:
2 6,022 1023 = 12,044 1023 nguyên tử nhôm
- 1,5 mol nguyên tử carbon là lượng carbon có chứa:
1,5 6,022 1023 = 9,033 1023 nguyên tử carbon
II KHỐI LƯỢNG MOL
Khái niệm
Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó.
Đơn vị: gam/mol
Khối lượng mol nguyên tử hay phân tử của một chất có cùng trị số với khối lượng nguyên tử hay phân tử chất đó tính theo đơn vị amu.
Khối lượng nguyên tử Na là 23 amu ® Khối lượng mol nguyên tử Na: MNa = 23 g/mol
Khối lượng nguyên tử O là 16 amu ® Khối lượng mol nguyên tử O: MO = 16 gam/mol
Khối lượng phân tử HCl là 36,5 amu ® Khối lượng mol phân tử HCl: MHCl = 36,5 g/mol
Khối lượng phân tử H2O là 18 amu, khối lượng mol phân tử H2O: MH2O = 18 gam/mol
Bài tập
Câu hỏi 2 (SGK tr.28). Quan sát hình 4.3, cho biết khối lượng 1 mol nguyên tử đồng và khối lượng 1 mol phân tử sodium chloride?
Khối lượng của N nguyên tử đồng và N phân tử sodium chloride
Khối lượng 1 mol nguyên tử đồng: MCu = 64 g/mol
Khối lượng 1 mol nguyên tử sodium chloride: MNaCl = 58,5 g/mol
Câu hỏi 3 (SGK tr.28). Dựa vào bảng tuần hoàn các nguyên tố hóa học, cho biết khối lượng mol nguyên tử hydrogen, nitrogen và magnesium?
Khối lượng mol nguyên tử hydrogen: MH = 1 g/mol
Khối lượng mol nguyên tử nitrogen: MN = 14 g/mol
Khối lượng mol nguyên tử magnesium: MMg = 24 g/mol
III. CHUYỂN ĐỔI GIỮA SỐ MOL CHẤT VÀ KHỐI LƯỢNG
HOẠT ĐỘNG NHÓM
Ví dụ (SGK tr.29):
Đốt cháy hoàn toàn 6 gam carbon trong khí oxygen. Tính số mol carbon đã bị đốt cháy, biết khối lượng mol của carbon là 12 gam/mol?
HOẠT ĐỘNG NHÓM
Gợi ý:
- 1 mol carbon nặng bao nhiêu gam?
- Gọi n là số mol carbon cần tìm thì n mol carbon nặng bao nhiêu gam?
- Tính n như thế nào?
Hãy rút ra các công thức liên quan nếu đặt n là số mol chất, M là khối lượng mol chất và m là khối lượng chất?
Đặt:
n là số mol chất
M là khối lượng mol chất
m là khối lượng chất
n = (mol) m = n M (gam)
M = (gam/mol)
Trả lời câu hỏi
Áp dụng các công thức đã rút ra ở trên để hoàn thành bảng sau:
Chất | Khối lượng phân tử (g/mol) | Khối lượng (g) | Số mol |
Urea | ? | 3 | 0,05 |
Nước | 18 | 27 | ? |
Sắt | 56 | ? | 0,2 |
IV
THỂ TÍCH MOL CỦA
CHẤT KHÍ
Khái niệm
Đọc mục IV (SGK tr.28) và trả lời câu hỏi:
- Nêu khái niệm thể tích mol của chất khí
- Trong cùng một điều kiện nhiệt độ và áp suất thì thể tích và khối lượng mol của chúng như nào?
Khái niệm
Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó
Một mol bất kì chất khí nào cũng chiếm những thể tích bằng nhau khi ở cùng điều kiện nhiệt độ và áp suất
Bài tập
Câu hỏi 4 (SGK tr.29). Quan sát hình 4.4. cho biết ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là bao nhiêu?
Ở điều kiện áp suất chuẩn, thể tích 1 mol khí là 24,79 l
Hình 4.4. Thể tích mol của một số khí ở 25oC, 1 bar
Câu hỏi 4 (SGK tr.29). Quan sát hình 4.4. cho biết ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là bao nhiêu?
Ở điều kiện áp suất chuẩn, thể tích 1 mol khí là 24,79 l
Hình 4.4. Thể tích mol của một số khí ở 25oC, 1 bar
Mở rộng kiến thức
- Giá trị 1 bar = 105 Pa, xấp xỉ bằng áp suất khí quyển ở độ cao ngang mặt nước biển hoặc vùng đồng bằng nơi ta đang sống.
- Ở cùng điều kiện nhiệt độ và áp suất, thể tích mol của chất rắn hoặc chất lỏng là khác nhau.
CHUYỂN ĐỔI GIỮA LƯỢNG CHẤT VÀ THỂ TÍCH CHẤT KHÍ
HOẠT ĐỘNG CẶP ĐÔI
Quan sát bảng 4.1 (SGK tr.30): Nêu mối liên hệ giữa thể tích và số mol khí
Bảng 4.1. Mối liên hệ giữa thể tích và số mol chất khí oxygen
Thể tích khí (lít) | 4,9858 | 12,395 | 24,79 | 49,58 |
Số mol khí (lít) | 0,2 | 0,5 | 1 | 2 |
Quan sát bảng nhận thấy thể tích 1 mol khí oxygen là bao nhiêu?
Vậy thể tích 2 mol, 0,5 mol khí oxygen lần lượt bao nhiêu?
Rút ra được mối liên hệ gì giữa thể tích và số mol khí oxygen?
Hãy rút ra các công thức chuyển đổi giữa số mol (n) và thể tích (V) của các chất khí ở điều kiện chuẩn (đktc)?
n là số mol chất khí
V là thể tích chất khí ở điều kiện chuẩn
V = 24,79 n (lít) n = (mol)
Bài tập
Vận dụng công thức chuyển đổi giữa số mol và thể tích khí để thực hiện các ví dụ sau:
Câu 1. Ở 25 oC và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu?
Lời giải:
Thể tích 1,5 mol khí 25 oC, 1 bar là:
V = 24,791,5 = 37,185 (l)
Vận dụng công thức chuyển đổi giữa số mol và thể tích khí để thực hiện các ví dụ sau:
Câu 2. Một hỗn hợp gồm 1 mol khí oxygen với 4 mol khí nitrogen. Ở 25 oC và 1 bar, hỗn hợp khí này có thể tích là bao nhiêu ?
Lời giải:
- Số mol khí là: 1 + 4 = 5 (mol)
- Thể tích hỗn hợp khí thu được là: V = 24,795 = 123,95 (l)
-----------------Còn tiêp-----------------------
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Xem thêm giáo án khác
GIÁO ÁN TỰ NHIÊN 8 CÁNH DIỀU
Giáo án Toán 8 cánh diều
Giáo án điện tử toán 8 cánh diều
Giáo án KHTN 8 cánh diều
Giáo án điện tử KHTN 8 cánh diều
Giáo án Công nghệ 8 cánh diều
Giáo án điện tử công nghệ 8 cánh diều
Giáo án Tin học 8 cánh diều
Giáo án điện tử Tin học 8 cánh diều
GIÁO ÁN XÃ HỘI 8 CÁNH DIỀU
Giáo án Ngữ văn 8 cánh diều
Giáo án điện tử ngữ văn 8 cánh diều
Giáo án Lịch sử và địa lí 8 cánh diều
Giáo án điện tử lịch sử và địa lí 8 cánh diều
Giáo án Công dân 8 cánh diều
Giáo án điện tử công dân 8 cánh diều
