Bài giảng điện tử hóa học 8 kết nối tri thức
Bài giảng Powerpoint, bài giảng điện tử hóa học 8 chương trình mới sách kết nối tri thức. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Giáo án có nhiều hình ảnh đẹp, tư liệu sinh động. Chắc chắn bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng. Powerpoint hóa học 8 kết nối tri thức.
Click vào ảnh dưới đây để xem giáo án rõ











Xem video về:Bài giảng điện tử hóa học 8 kết nối tri thức
Đầy đủ Giáo án hóa học THCS kết nối tri thức
- Bài giảng điện tử hóa học 8 kết nối tri thức
- Bài giảng Powerpoint hóa học 7 kết nối tri thức
- Tải GA word hóa học 7 kết nối tri thức
- Tải bài giảng điện tử hóa học 6 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC HÔM NAY!
KHỞI ĐỘNG
Bằng phép đo thông thường, ta chỉ xác định được khối lượng chất rắn, chất lỏng hoặc thể tích của chất khí. Làm thế nào để biết lượng chất có bao nhiêu phân tử, nguyên tử?
Hãy nêu khối lượng của hạt proton, neutron, electron, của nguyên tử carbon, phân tử oxygen,…
CHƯƠNG 1:
PHẢN ỨNG HÓA HỌCBÀI 3:
MOL VÀ TỈ KHỐI CỦA CHẤT KHÍ
NỘI DUNG BÀI HỌC
- Mol
Trong toán học, người ta quy định :
- 1 tá trứng bằng bao nhiêu quả trứng?
- 1 chục quả trứng bằng bao nhiêu quả trứng?
- Khái niệm
- Số 6,022.1023 được gọi là số Avogadro, được kí hiệu là NA
- Mol là lượng chất có chứa NA (6,022.1023) nguyên tử hoặc phân tử của chất đó.
Ví dụ
- a) 12 gam carbon có NA nguyên tử C hay 1 mol nguyên tử carbon
- a) 12 gam carbon có NA nguyên tử C hay 1 mol nguyên tử carbon
- c) 18 gam nước có NA phân tử H2O hay 1 mol phân tử nước
Đọc thông tin Hình 3.1 và so sánh khối lượng của 1 mol nguyên tử carbon, 1 mol phân tử iodine và 1 mol phân tử nước.
SOẠN HÓA HỌC 6 KNTT ĐẦY ĐỦ:
Khối lượng 1 mol nguyên tử C < khối lượng 1 mol phân tử H2O < khối lượng 1 mol phân tử I2.
- Khối lượng mol
Khối lượng mol của một chất là gì?
Khối lượng mol (kí hiệu là M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
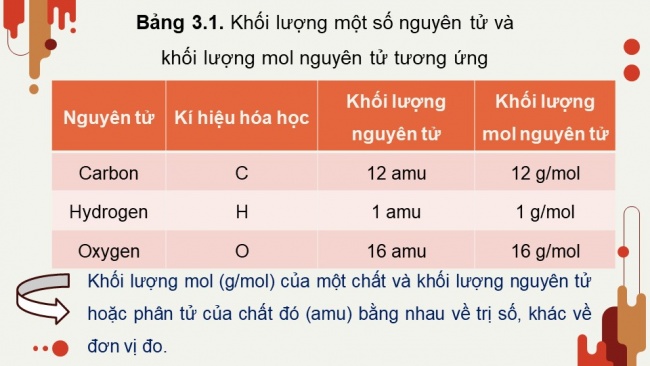
Bảng 3.1. Khối lượng một số nguyên tử và khối lượng mol nguyên tử tương ứng
Nguyên tử | Kí hiệu hóa học | Khối lượng nguyên tử | Khối lượng mol nguyên tử |
Carbon | C | 12 amu | 12 g/mol |
Hydrogen | H | 1 amu | 1 g/mol |
Oxygen | O | 16 amu | 16 g/mol |
Khối lượng mol (g/mol) của một chất và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
Gọi n là số mol chất có trong m gam. Khối lượng mol (M) được tính theo công thức:
SOẠN GIÁO HÓA HỌC 7 KNTT CHI TIẾT:
M = (g/mol)
Gọi n là số mol chất có trong m gam. Khối lượng mol (M) được tính theo công thức:
M = (g/mol)
Ví dụ: Khối lượng mol nguyên tử Na là MNa = 23 g/mol
Khối lượng mol phân tử HCl: MHCl = 36,5 g/mol
Hoàn thành bảng sau:
Chất | Khối lượng phân tử (g/mol) | Khối lượng (g) |
| Số mol |
Urea | ? | 3 |
| 0,05 |
Nước | 18 | 27 |
| ? |
Sắt | 56 | ? |
| 0,2 |
CH1. Tính khối lượng mol của chất X, biết rằng 0,4 mol chất này có khối lượng là 23,4 gam.
CH2. Tính số mol phân tử có trong 9 gam nước, biết rằng khối lượng mol của nước là 18 g/mol.
Trả lời CH1 :
Khối lượng mol của chất X :
M = = 58,5 (g/mol)
Trả lời CH2 :
Số mol nước là:
n = (mol)
SOẠN HÓA HỌC 8 KNTT KHÁC:
- Thể tích mol của chất khí
Nêu khái niệm thể tích mol của chất khí
Trong cùng một điều kiện nhiệt độ và áp suất thì khối lượng mol của chúng như nào?
Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khí đó.
Thể tích mol của các chất khí bất kì ở cùng điều kiện nhiệt độ và áp suất đều bằng nhau.
Ở điều kiện chuẩn (25oC và 1 bar), n mol chất khí bất kì đều chiếm thể tích là V = 24,79.n (L).
THẢO LUẬN CẶP ĐÔI
Tìm thể tích của:
- 1 mol phân tử khí O2 ở đktc
- 2 mol phân tử khí H2 ở đktc
Ví dụ: Ở đktc:
- Thể tích của 1 mol phân tử khí O2 là 22,4 L.
- Thể tích của 2 mol phân tử khí H2 là 44,8 L.
Lưu ý
- Giá trị 1 bar = 105 Pa, xấp xỉ bằng áp suất khí quyển ở độ cao ngang mặt nước biển hoặc vùng đồng bằng nơi ta đang sống.
- Ở cùng điều kiện nhiệt độ và áp suất, thể tích mol của chất rắn hoặc chất lỏng là khác nhau.
Câu 1. Ở 25 oC và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu?
- Thể tích 1,5 mol khí 25 oC, 1 bar là:
- V = 24,79.1,5 = 37,185 (L)
Câu 2. Một hỗn hợp gồm 1 mol khí oxygen với 4 mol khí nitrogen. Ở 25 oC và 1 bar, hỗn hợp khí này có thể tích là bao nhiêu ?
- Số mol khí là: 1 + 4 = 5 (mol)
- Thể tích hỗn hợp khí thu được là:
- V = 24,79.5 = 123,95 (L)
- Tỉ khối chất khí
Hãy nêu công thức tính tỉ khối giữa hai chất khí.
Tỉ khối của khí A đối với khí B được biểu diễn bằng công thức:
dA/B =
Hãy cho biết khí CO2 nặng hay nhẹ hơn khí H2 bao nhiêu lần?
Trả lời:
Vậy khí CO2 nặng hơn khí H2 22 lần.
Thảo luận cặp đôi
Người ta bơm khí nào vào bóng bay để bóng bay bay lên được?
Nếu bơm khí oxi hoặc khí carbon dioxide thì bóng bay có bay lên cao được không? Vì sao?
Quả bóng bay được bơm đầy khí hydrogen bay lên cao rất nhanh, chứng tỏ khí hydrogen nhẹ hơn không khí. Nhưng nếu quả bóng bay được thổi căng bằng khí carbon dioxide, nó sẽ nằm trên mặt đất chứ không bay lên, chứng tỏ khí carbonic nặng hơn không khí. Vậy làm thế nào để xác định tỉ khối của một chất khí đối với không khí ?
Tỉ khối của khí A đối với không khí là:
SOẠN GIÁO ÁN TẤT CẢ CÁC MÔN LỚP 8 MỚI:
- Giáo án tất cả các môn lớp 8 chân trời sáng tạo
- Giáo án tất cả các môn lớp 8 kết nối tri thức
- Giáo án tất cả các môn lớp 8 cánh diều
dA/kk =
Câu1. a) Khí carbon dioxide (CO2) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
- b) Trong lòng hang sâu thường xảy ra quá trình phân hủy chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Hãy cho biết khí carbon dioxide tích tụ ở trên nền hang hay bị không khí đẩy bay lên trên.
- a) Tỉ khối của carbon dioxide so với không khí là
Vậy carbon dioxide nặng hơn không khí 1,517 lần
- b) Khí carbon dioxide bị tích tụ trong hang.
Trò chơi hái hoa dân chủ
Câu hỏi 1: Số Avogadro và kí hiệu là
- 6,022.1023, A
- 6,022.10-23, A
- 6,022.1023, N
- 6,022.10-24, N
Câu hỏi 2: Khối lượng mol chất là
- Khối lượng ban đầu của chất đó
- khối lượng sau khi tham gia phản ứng hóa học
- bằng 6,022.1023
- khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó.
Câu hỏi 3: 1 mol chất khí ở điều kiện chuẩn có thể tích là
- 2,47 L
- 0,247 L
- 24,79 L
- 24,79 mL
Câu hỏi 4: Thể tích mol là
- thể tích của chất lỏng
- thể tích của 1 nguyên tử nào đó
- thể tích chiếm bởi NA phân tử của chất khí đó
- thể tích ở đktc là 24,79 L
Câu hỏi 5: Thể tích ở đktc của 2,25 mol O2 là
- 24,79 L
- 50 L
- 5,57 L
- 55,78 L
Câu hỏi 6: Số mol của H2 ở đktc biết
V = 5,6 L là
- 0,25 mol
- 0,3 mol
- 0,224 mol
- 0,23 L
Câu hỏi 7: Số mol của kali biết có 6,022.1023 nguyên tử kali
- 1 mol
- 1,5 mol
- 0,5 mol
- 0,25 mol
Câu hỏi 8: Khí SO2 nặng hay nhẹ hơn không khí bao lần
- Nặng hơn không khí 2,2 lần
- Nhẹ hơn không khí 3 lần
- Nặng hơn không khí 2,4 lần
- Nhẹ hơn không khí 2 lần
Câu hỏi 9: Có thể thu khí N2 bằng cách nào?
- Đặt đứng bình
- Đặt úp bình
- Đặt ngang bình
D.Cách nào cũng được
Câu hỏi 10: Trong các khí sau, số khí nhẹ hơn không khí là: CO2, H2O, N2, SO2
- 5
- 4
- 3
- 2
Bài 1. Tính số nguyên tử, phân tử có trong mỗi lượng chất sau:
- a) 0,25 mol nguyên tử C
- b) 0,002 mol phân tử I2
- c) 2 mol phân tử H2O
Bài 2. a) Khí methane (CH4) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
- b) Dưới đáy giếng thường xảy ra quá trình phân hủy chất hữu cơ, sinh ra khí methane. Hãy cho biết khí methane tích tụ dưới đáy giếng hay bị không khí đẩy bay lên trên.
Trả lời
Bài 1.
- a) Số nguyên tử có trong 0,25 mol C là:
0,25 6,022 1023 = 1,5055 1023 (nguyên tử)
- b) Số phân từ có trong 0,002 mol phân tử I2 là
0,002 6,022 1023 = 1,2044 1021 (phân tử)
- c) Số phân tử có trong 2 mol H2O là:
2 6,022 1023 = 1,2044 1024 (phân tử)
Bài 2.
- a) Tỉ khối của methane so với không khí là:
Vậy methane nhẹ bằng 0,552 lần không khí.
- b) Khí methane bị đẩy bay lên trên miệng giếng.
HƯỚNG DẪN VỀ NHÀ
- Ôn lại kiến thức đã học.
- Hoàn thành bài tập vận dụng.
- Làm bài tập trong SBT KHTN 8.
- Đọc và tìm hiểu trước nội dung Bài 4: Dung dịch và nồng độ
CẢM ƠN CÁC EM
ĐÃ LẮNG NGHE BÀI GIẢNG HÔM NAY!
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Xem thêm giáo án khác
GIÁO ÁN TỰ NHIÊN 8 KẾT NỐI TRI THỨC
Giáo án Toán 8 kết nối tri thức
Giáo án điện tử toán 8 kết nối tri thức
Giáo án KHTN 8 kết nối tri thức
Giáo án điện tử KHTN 8 kết nối tri thức
Giáo án Công nghệ 8 kết nối tri thức
Giáo án điện tử công nghệ 8 kết nối tri thức
Giáo án Tin học 8 kết nối tri thức
Giáo án điện tử Tin học 8 kết nối tri thức
GIÁO ÁN XÃ HỘI 8 KẾT NỐI TRI THỨC
Giáo án Ngữ văn 8 kết nối tri thức
Giáo án điện tử ngữ văn 8 kết nối tri thức
Giáo án Lịch sử và địa lí 8 kết nối tri thức
Giáo án điện tử lịch sử và địa lí 8 kết nối tri thức
Giáo án Công dân 8 kết nối tri thức
Giáo án điện tử công dân 8 kết nối tri thức
GIÁO ÁN LỚP 8 CÁC MÔN CÒN LẠI
Giáo án điện tử âm nhạc 8 kết nối tri thức
Giáo án Mĩ thuật 8 kết nối tri thức
Giáo án điện tử mĩ thuật 8 kết nối tri thức
Giáo án Hoạt động trải nghiệm 8 kết nối tri thức
Giáo án điện tử hoạt động trải nghiệm 8 kết nối tri thức
Giáo án Thể dục 8 kết nối tri thức
GIÁO ÁN LỚP 8 BỘ SÁCH KHÁC
Giáo án tất cả các môn lớp 8 cánh diều
Giáo án tất cả các môn lớp 8 chân trời sáng tạo
