Đề cương ôn tập Hóa học 7 cánh diều học kì 1
Đề cương ôn tập môn Hóa học lớp 7 bộ sách cánh diều mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 7. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
1. NGUYÊN TỬ
- Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
- Cấu tạo nguyên tử gồm vỏ nguyên tử và hạt nhân nguyên tử.
- Vỏ nguyên tử gồm một hay nhiều electron mang điện tích âm. Mỗi hạt electron mang điện tích -1.
- Hạt nhân của nguyên tử mang điện tích dương, được tạo bởi các proton (p) mang điện tích dương và neutron (n) không mang điện.
- Mỗi hạt proton mang điện tích +1.
- Điện tích hạt nhân nguyên tử = tổng điện tích các proton.
- Số đơn vị điện tích hạt nhân = số proton.
- Nguyên tử trung hòa về điện => số proton = số electron.
- Theo mô hình Rơ-dơ-pho – Bo, trong nguyên tử, electron phân bố trên các lớp electron và chuyển động quanh hạt nhân nguyên tử trên những quỹ đạo xác định.
- Electron phân bố trên các lớp electron theo chiều từ gần hạt nhân ra ngoài.
- Số electron tối đa trên mỗi lớp được xác định, như lớp thứ nhất có tối đa 2 electron, từ lớp thứ hai có tối đa 8 electron,…
- Khối lượng nguyên tử được coi bằng tổng khối lượng của proton và neutron có trong nguyên tử, được tính bằng đơn vị amu.
2. NGUYÊN TỐ HÓA HỌC
- Nguyên tố hoá học là tập hợp những nguyên tử có cùng số proton trong hạt nhân.
- Nguyên tố hóa học đặc trưng bởi số proton trong nguyên tử.
- Các nguyên tử của cùng một nguyên tố đều có chung tính chất hóa học.
- Cho đến nay, Liên minh Quốc tế về Hóa học thuần túy và Hóa học ứng dụng (IUPAC) đã công bố tìm thấy 118 nguyên tố hóa học gồm: 90 nguyên tố trong tự nhiên; Số còn lại do con người tổng hợp, được gọi là nguyên tố nhân tạo.
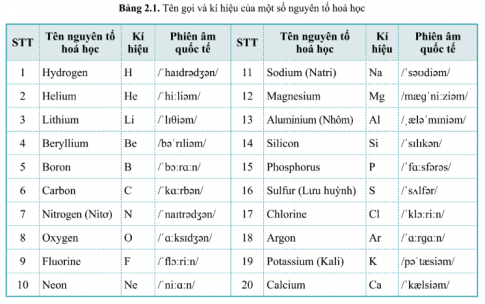
- Mỗi nguyên tố hoá học có tên gọi và kí hiệu hoá học riêng.
- Kí hiệu hoá học của nguyên tố được biểu diễn bằng một hoặc hai chữ cái trong tên nguyên tố; trong đó, chữ cái đầu tiên được viết ở dạng chữ in hoa, chữ cái thứ hai (nếu có) được viết ở dạng chữ thường.
3. SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. Các nguyên tố cùng chu kì có cùng số lớp electron. Các nguyên tố cùng nhóm có tính chất hoá học tương tự nhau.
- Bảng tuần hoàn gồm các nguyên tố hoá học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm.
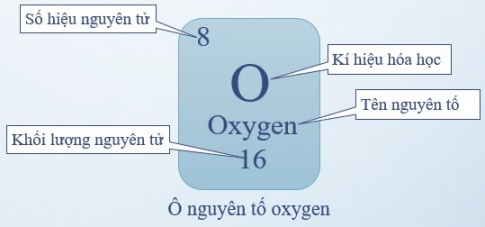
- Ô nguyên tố: là một ô trong bảng tuần hoàn tương ứng với một nguyên tố hóa học.
Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, khối lượng nguyên tử.
Số hiệu nguyên tử (kí hiệu là Z) = số đơn vị điện tích hạt nhân (= số proton và = số electron) và là số thứ tự của nguyên tố
Ví dụ: Ô nguyên tố oxygen
- Chu kì gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
Số thứ tự của chu kì = số lớp electron của nguyên tố.
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
Số thứ tự của nhóm A = số electron lớp ngoài cùng.
- Bảng tuần hoàn cho biết: các thông tin của một nguyên tố; vị trí của các nguyên tố; nguyên tố đó là kim loại, phi kim hay khí hiếm.
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn => các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
- Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên => Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
- Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.


Bình luận