Đề cương ôn tập KHTN 7 Cánh diều học kì 1
Đề cương ôn tập môn Khoa học tự nhiên lớp 7 bộ sách Cánh diều là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Khoa học tự nhiên lớp 7. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
Chủ đề 1: Nguyên tử. Nguyên tố hóa học
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
Nguyên tử được coi như một quả cầu, cấu tạo gồm
- hạt nhân nguyên tử: gồm proton (kí hiệu: p; mỗi proton mang điện tích +1) và neutron (kí hiệu: n; không mang điện).
- vỏ nguyên tử được tạo bởi một hay nhiểu electron chuyển động xung quanh hạt nhân (kí hiệu: e; mỗi hạt electron mang điện tích -1.)
- Điện tích hạt nhân nguyên tử = tổng điện tích các proton.
- Số đơn vị điện tích hạt nhân = số proton = số electron ⇒ Nguyên tử trung hòa về điện
- Mô hình nguyên tử của Rơ-dơ-pho – Bo:
- Electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân.
- Electron phân bố trên các lớp electron theo chiều từ gần hạt nhân ra ngoài.
- Số electron tối đa trên mỗi lớp được xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ hai có tối đa 8 electron,…
- Đơn vị đo khối lượng nguyên tử: amu (atomic mass unit) 1 amu = 1,6605. 10$^{-24}$g.
- Khối lượng của một nguyên tử = khối lượng của proton + khối lượng của neutron + khối lượng của electron ≈ khối lượng của proton + khối lượng của neutron ( do do khối lượng của electron rất nhỏ)
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng số proton trong hạt nhân. Nguyên tố hóa học đặc trưng bởi số proton trong nguyên tử. Các nguyên tử của cùng một nguyên tố đều có chung tính chất hóa học.
- Mỗi nguyên tố hóa học đều có tên riêng. Mỗi nguyên tố hóa học được biểu diễn bằng một kí hiệu riêng, được gọi là kí hiệu hóa học của nguyên tố.
Chủ đề 2: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được xếp theo quy luật trong một bảng, gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn).
- Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
- Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau.
- Cấu tạo bảng tuần hoàn
- Ô nguyên tố cho biết:
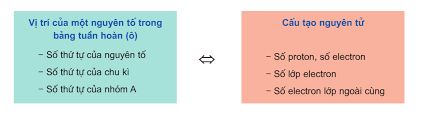
- Số hiệu nguyên tử (kí hiệu là Z) = số đơn vị điện tích hạt nhân = số proton = số electron = số thứ tự của nguyên tố
- Kí hiệu hóa học
- Tên nguyên tố
- Khối lượng nguyên tử,...
- Chu kì:
- Các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
- STT của chu kì = số lớp e của nguyên tố
- Bảng tuần hoàn có 7 chu kì (3 chu kì nhỏ và 4 chu kì lớn)
- Nhóm:
Các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
Bảng tuần hoàn gồm 18 cột (8 cột là nhóm A: từ IA đến VIIIA và 10 cột nhóm B: từ IB đến VIIIB)
- Số thứ tự của nhóm A = số electron lớp ngoài cùng.
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn. Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên. Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.
- Ý nghĩa của bảng tuần hoàn
Chủ đề 3: Phân tử
- Phân tử là hạt đại diện cho chất, gồm một số nguyên tử gắn kết với nhau bằng liên kết hóa học và thể hiện đầy đủ tính chất hóa học của chất.
- Khối lượng phân tử (kí hiệu là M) = tổng khối lượng các nguyên tử có trong phân tử. Đơn vị: amu
- Đơn chất là những chất được tạo thành từ một nguyên tố hóa học. Hợp chất là những chất do hai hoặc nhiều nguyên tố hóa học tạo thành.
- Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm. Chất được tạo thành các ion dương và ion âm được gọi là hợp chất ion. Tính chất chung của hợp chất ion: Là chất rắn ở điều kiện thường, thường có nhiệt độ nóng chảy và nhiệt độ sôi cao, khi tan trong nước tạo ra dung dịch dẫn điện.
- Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử. Một số đặc điểm của chất cộng hóa trị: Có cả ba thể, Các chất cộng hóa trị thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp, nhiều chất cộng hóa trị không dẫn điện (đường ăn, ethanol,…).
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác. Trong hợp chất, H luôn có hóa trị I, O luôn có hóa trị II.
- Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
- Công thức hóa học dùng để biểu diễn chất. Gồm phần chữ và phần số.

Công thức hóa học của một số chất cho biết một số thông tin
- Nguyên tố tạo ra chất.
- Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
- Khối lượng phân tử của chất.
- Tính được phần trăm khối lượng các nguyên tố trong hợp chất
Chủ đề 4: Tốc độ
- Tốc độ cho ta biết một vật chuyển động nhanh hay chậm
- Biểu thức: v = $\frac{s}{t}$
- Một số đơn vị của quãng đường, thời gian, tốc độ
s | m | km | km | m |
t | s | h | phút | phút |
v | m/s | km/h | km/phút | m/phút |
- Có thể đo tốc độ bằng đồng hồ bấm giây, đồng hồ đo thời gian hiện số và cổng quang điện, thiết bị “Bắn tốc độ”,...
- Đồ thị quãng đường – thời gian
Chủ đề 5: Âm thanh
- Vật phát ra âm được gọi là nguồn âm. Khi phát ra âm, các nguồn âm đều rung động
- Môi trường truyền âm: rắn, lỏng, khí
- Khi một vật có độ lệch lớn nhất của vật so với vị trí cân bằng của nó được gọi là biên độ của dao động
- Biên độ dao động của vật phát ra âm càng lớn, âm càng to
- Biên độ dao động của vật phát ra âm càng nhỏ, âm càng nhỏ.
- Độ to của âm được đo bằng đơn vị đêxiben, kí hiệu dB.
-Tần số là số dao động trong 1 giây. Đơn vị: Hz
- Tần số của dao động càng lớn, âm càng cao (càng bổng)
- Tần số của dao động càng nhỏ, âm càng thấp (càng trầm).
- Âm dội lại khi gặp một mặt chắn gọi là âm phản xạ
- Mọi vật đều phản xạ âm truyền đến nó. Với các vật làm từ cùng chất liệu, vật có bề mặt phẳng phản xạ âm tốt hơn so với vật có bề mặt gồ ghề.
- Tiếng ồn gây ô nhiễm là tiếng ồn lớn và kéo dài làm ảnh hưởng xấu đến sức khỏe và hoạt động bình thường của con người
- Biện pháp chống ô nhiễm tiếng ồn: Treo biển báo “Câm bóp còi”, Xây dựng tường ngăn cách khu dân cư với đường cao tốc, Trồng nhiều cây xanh, Làm trần nhà, tường nhà dày,...
Chủ đề 6: Ánh sáng
- Ánh sáng là một dạng của năng lượng. Nguồn sáng là vật tự nó phát ra ánh sáng cùng với sự tỏa nhiệt
- Từ bề mặt của một vật phát sáng, ánh sáng phát ra theo mọi hướng
- Ánh sáng truyền trong các môi trường trong suốt và đồng tính như không khí, thủy tinh, nước, ... thì ánh sáng đi theo đường thẳng. Trong thực tế, không thể nhìn thấy một tia sáng mà chỉ nhìn thấy chùm sáng gồm nhiều tia sáng hợp thành
- Các chùm sáng thường gặp: Chùm sáng song song, Chùm sáng phân kì, Chùm sáng hội tụ
- Khi chiếu ánh sáng từ một nguồn sáng nhỏ vào một vật cản sáng có kích thước lớn hơn nguồn sáng, phía sau vật cản sẽ xuất hiện một vùng tối. Nếu ta đặt một màn hứng ánh sáng phía sau vật cản, trên màn có phần không nhận được ánh sáng từ nguồn sáng, ta gọi là bóng tối.
- Khi chiếu ánh sáng từ một nguồn sáng lớn vào một vật cản sáng, phía sau vật cản sẽ xuất hiện vùng tối và vùng nửa tối. Nếu ta đặt một màn hứng ánh sáng phía sau vật cản, trên màn có phần không nhận được ánh sáng từ nguồn sáng, ta gọi là bóng tối, có phần nhận được ít ánh sáng truyền tới, ta gọi là bóng nửa tối.
- Hiện tượng phản xạ ánh sáng: là hiện tượng ánh sáng bị hắt trở lại theo hướng khác
- Định luật phản xạ ánh sáng: Tia sáng phản xạ nằm trong mặt phẳng tới, góc phản xạ bằng góc tới -
- Phân loại: phản xạ phản xạ gương, phản xạ khuếch tán


Bình luận