Đề cương ôn tập Hóa học 10 cánh diều học kì 1 (P1)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách cánh diều mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ 1: CẤU TẠO NGUYÊN TỬ
1. Các thành phần của nguyên tử
- Nguyên tử được tạo nên từ 3 loại hạt cơ bản là:
+ Hạt electron, kí hiệu là e
+ Hạt proton, kí hiệu là p
+ Hạt neutron, kí hiệu là n
- Trong một nguyên tử, số proton và số electron luôn bằng nhau.
- Trong tất cả các nguyên tố, chỉ có duy nhất một loại nguyên tử của hydrogen (H) được tạo nên bởi proton và electron (không có neutron).
Chú ý:
+ Đơn vị của khối lượng nguyên tử là amu (atomic mass unit)
1 amu = 1,6605.10-27 kg
+ Đơn vị của điện tích các hạt cơ bản là e0 (điện tích nguyên tố)
1 e0 = 1,602.10-19 C
- Nguyên tử bao gồm:
+ Lớp vỏ: được tạo nên bởi các hạt electron
+ Hạt nhân: được tạo nên bởi các hạt proton và hạt neutron
Ví dụ: Mô hình cấu tạo nguyên tử hydrogen và beryllium
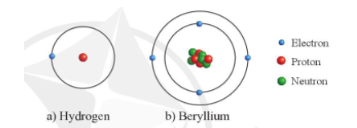
- Khối lượng của nguyên tử
+ Khối lượng của nguyên tử vô cùng nhỏ.
+ Khối lượng nguyên tử thường được biểu thị theo đơn vị amu
+ Nguyên tử có khối lượng nhỏ nhất là nguyên tử của nguyên tố hydrogen (H), có khối lượng là 1 amu
+ Nguyên tử có khối lượng lớn nhất là nguyên tử của nguyên tố uranium (U), có khối lượng là 238 amu
+ Do khối lượng của các electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu) nên khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử. Một cách gần đúng, có thể coi khối lượng của nguyên tử bằng khối lượng của hạt nhân.
- Kích thước của nguyên tử là vô cùng nhỏ. Coi nguyên tử có dạng hình cầu, khi đó, đường kính của nó chỉ khoảng 10-10 m
2. Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử trong hình dưới đây đều có một proton (hạt màu xanh) trong hạt nhân nên thuộc cùng một nguyên tố hóa học, nguyên tố hydrogen (H).
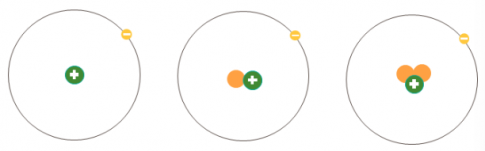
- Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
- Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A. Ta có: A = Z + N
- Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).
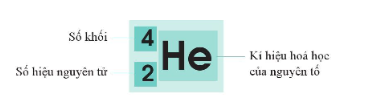
- Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau. Do đó, đồng vị của cùng một nguyên tố hóa học (có cùng số proton) khác nhau về số khối do đó số neutron khác nhau.
- Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Công thức tính nguyên tử khối trung bình như sau:
3. Mô hình nguyên tử và orbital nguyên tử
- Mô hình nguyên tử của Rutherford – Bohr có các nội dung chính sau:
+ Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
+ Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
+ Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì có năng lượng càng cao.
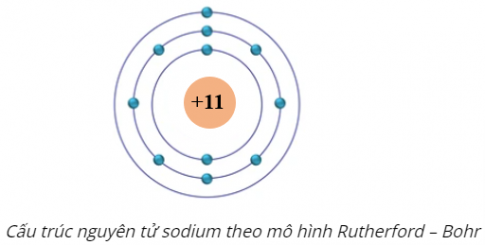
- Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của mỗi lớp như sau:
+ Lớp thứ nhất gọi là lớp K.
+ Lớp thứ hai gọi là lớp L.
+ Lớp thứ ba gọi là lớp M.
+ Lớp thứ tư gọi là lớp N.
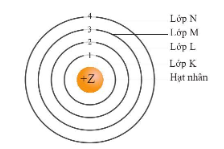
- Theo mô hình hiện đại về nguyên tử:
+ Các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo xác định.
+ Electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau, sự chuyển động này tạo nên một hình ảnh giống như một đám mây electron.
- Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%). Orbial nguyên tử có một số hình dạng khác nhau.
+ AO hình cầu, còn gọi là AO s;
+ AO hình số tám nổi, còn gọi là AO p (tùy theo vị trí của AO p trên hệ trục tọa độ Đề - các, sẽ gọi là AO px, py và pz).
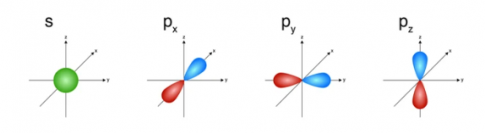
- Một AO chỉ chứa tối đa 2 electron, 2 electron này được gọi là cặp electron ghép đôi. - Nếu AO chỉ có 1 electron, electron đó được gọi là electron độc thân. Nếu AO không chứa electron nào thì được gọi là AO trống.
4. Lớp, phân lớp và cấu hình electron
- Số electron và số lượng AO trong lớp thứ n (n £ 4) được ghi nhớ theo quy tắc sau:
+ Lớp thứ n có n2 AO.
+ Lớp thứ n có tối đa 2n2 electron.
- Số lượng và kí hiệu các phân lớp trong một lớp: Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf, ... Cụ thể:
+ Lớp K (n =1): có 1 phân lớp, được kí hiệu là 1s.
+ Lớp L (n =2): có 2 phân lớp, được kí hiệu là 2s và 2p.
+ Lớp M (n =3): có 3 phân lớp, được kí hiệu là 3s, 3p và 3d.
- Số lượng AO trong mỗi phân lớp
+ Phân lớp ns chỉ có 1 AO.
+ Phân lớp np có 3 AO.
+ Phân lớp nd có 5 AO.
+ Phân lớp nf có 7 AO.
- Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên phải kí hiệu phân lớp. Phân lớp nào đã có tối đa electron được gọi là phân lớp bão hòa.
Lưu ý: Số lượng electron tối đa trong mỗi phân lớp
- Phân lớp ns chứa tối đa 2 electron.
- Phân lớp np chứa tối đa 6 electron.
- Phân lớp nd chứa tối đa 10 electron.
- Phân lớp nf chứa tối đa 14 electron.
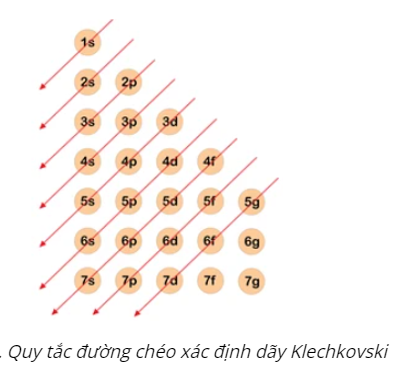
- Các bước viết cấu hình electron nguyên tử theo những nguyên tắc sau:
+ Quy tắc 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski): 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s...
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
- Quy tắc 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
- Quy tắc biểu diễn cấu hình electron theo orbital:
+ Quy tắc 1: Viết cấu hình electron của nguyên tử
+ Quy tắc 2: Biểu diễn mỗi AO bằng một ô vuông (orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
+ Quy tắc 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên.
Mở rộng: Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vậy chúng có xu hướng tách nhau ra và chiếm hai AO khác nhau. Đây là lí do vì sao trong một phân lớp, các electron cần được sắp xếp sao cho số electron độc thân là lớn nhất.
- Các electron thuộc lớp ngoài cùng có vai trò quyết định đến tính chất hóa học đặc trưng của nguyên tố (tính kim loại, tính phi kim, tính trơ, ...). Từ cấu hình electron có thể dự đoán các tính chất này theo quy tắc sau:
+ Quy tắc 1: Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố kim loại. Tính kim loại thể hiện qua khả năng nhường electron trong các phản ứng hóa học (tính khử).
+ Quy tắc 2: Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim. Tính phi kim thể hiện qua khả năng nhận electron trong các phản ứng hóa học (tính oxi hóa).
+ Quy tắc 3: Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử nguyên tố khí hiếm. Các nguyên tố này rất khó tham gia các phản ứng hóa học (tính trơ).
+ Quy tắc 4: Nếu lớp electron ngoài cùng của một nguyên tử có 4 electron thì nguyên tử nguyên tố đó có thể là kim loại hoặc phi kim.

Bình luận