Đề cương ôn tập Hóa học 10 cánh diều học kì 1 (P2)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách cánh diều mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học
+ Các nguyên tố hóa học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân của nguyên tử.
+ Các nguyên tố mà nguyên tử có cùng số lớp electron được xếp vào cùng một hàng.
+ Các nguyên tố mà nguyên tử có số electron hóa trị như nhau được xếp vào cùng một cột.
Lưu ý: Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (thường là những electron ở lớp ngoài cùng).
- Bảng tuần hoàn các nguyên tố hóa học hiện nay (gọi tắt là bảng tuần hoàn) gồm 118 nguyên tố hóa học. Vị trí của mỗi nguyên tố hóa học trong bảng tuần hoàn được thể hiện qua số thứ tự ô nguyên tố, chu kì và nhóm.
+ Ô nguyên tố: Mỗi ô chứa một số thông tin của một nguyên tố hóa học như: kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử và nguyên tử khối trung bình,... Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
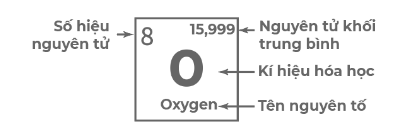
+ Chu kì: là tập hợp các nguyên tố hóa học mà nguyên tử của chúng có cùng số lớp electron, được xếp thành hàng theo chiều tăng dần điện tích hạt nhân từ trái sang phải. Bảng tuần hoàn gồm 7 chu kì, được đánh số từ 1 đến 7. Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố thuộc chu kì đó.
+ Nhóm: Bảng tuần hoàn gồm 18 cột, được chia thành 8 nhóm A, đánh số từ IA đến VIIIA; 8 nhóm B, được đánh số từ IB đến VIIIB. Mỗi nhóm A hay B đều chỉ có một cột, trừ nhóm VIIIB có ba cột.
- Từ cấu hình electron nguyên tử của một nguyên tố hóa học, có thể xác định được vị trí của nguyên tố đó trong bảng tuần hoàn theo quy tắc sau:
+ Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
+ Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của nguyên tố thuộc chu kì đó.
+ Nguyên tố nhóm A có cấu hình electron lớp ngoài cùng dạng ns1÷2 hoặc ns2np1÷6 và nguyên tố nhóm B có cấu hình electron phân lớp ngoài cùng và phân lớp sát lớp ngoài cùng dạng ( n - 1)d1÷10ns1÷2.
Với nguyên tố nhóm A, số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử nguyên tố đó (trừ He).
- Phân loại nguyên tố hóa học:
+ Dựa vào cấu hình electron nguyên tử, người ta phân loại các nguyên tố hóa học thành các khối nguyên tố s, p, d, f.
+ Dựa vào tính chất hóa học, các nguyên tố hóa học được phân loại thành kim loại, phi kim và khí hiếm.
2. Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
- Xu hướng biến đổi bán kính nguyên tử:
+ Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần.
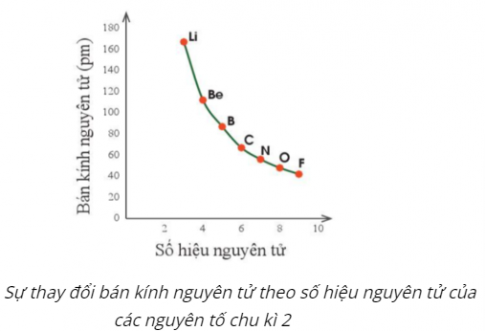
+ Quy luật chung đối với các nguyên tố nhóm A: Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng tăng dần.
- Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
+ Độ âm điện (χ – đọc là khi) là đại lượng đặc trưng cho khả năng hút electron liên kết của nguyên tử. Độ âm điện phụ thuộc đồng thời vào hai yếu tố: điện tích hạt nhân và bán kính nguyên tử.

+ Tính kim loại đặc trưng bởi khả năng nhường electron của nguyên tử. Tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử. Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần. Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
- Xu hướng biến đổi thành phần và tính acid, tính base của các oxide và các hydroxide theo chu kì
+ Oxide cao nhất của một nguyên tố là oxide mà trong đó, hóa trị của nguyên tố đó là cao nhất. Các nguyên tố thuộc các nhóm IA đến VIIA (trừ fluorine) có hóa trị cao nhất đúng bằng số thứ tự nhóm.
+ Xu hướng biến đổi thành phần của các oxide cao nhất: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tỉ số giữa số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất có xu hướng tăng dần.
+ Xu hướng biến đổi tính acid, tính base của oxide cao nhất: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
- Thành phần và tính acid, tính base của các hydroxide cao nhất trong một chu kì
+ Hydroxide của nguyên tố kim loại M hóa trị n có dạng M(OH)n. Đối với nguyên tố phi kim hydroxide của nó ở dạng acid.
+ Xu hướng biến đổi tính acid, tính base của hydroxide: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
3. Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
+ Các tính chất của các đơn chất, cũng như thành phần và tính chất của các hợp chất lặp đi lặp lại một cách có hệ thống và có thể dự đoán được khi các nguyên tố được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử vào các chu kì và nhóm.
+ Định luật tuần hoàn đã dẫn đến sự phát triển và hoàn thiện của bảng tuần hoàn các nguyên tố hóa học ngày nay.
- Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể đưa ra dự đoán về tính chất của đơn chất cũng như hợp chất của nó.

Bình luận