Đề cương ôn tập Hóa học 10 cánh diều học kì 1 (P3)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách cánh diều mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 1 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ: LIÊN KẾT HÓA HỌC
1. Quy tắc Octet
- Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
- Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững như của khí hiếm gần nhất với 8 electron ở lớp ngoài cùng (hoặc có 2 electron ở lớp ngoài cùng như của He).
- Nhận xét:
+ Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
+ Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng (các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
+ Ngoài cách các nguyên tử nhường và nhận electron để hình thành liên kết ion, quy tắc octet có thể đạt được bằng cách góp chung electron.
2. Liên kết ion
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Liên kết ion cũng có thể được hình thành từ ion đa nguyên tử.
- Quá trình hình thành liên kết ion diễn ra như sau:
+ Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron (tạo thành cation) và nguyên tử phi kim nhận electron (tạo thành anion) theo quy tắc octet.
+ Các ion trái dấu hút nhau bằng lực hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng 0.
Ví dụ: Quá trình hình thành liên kết ion trong phân tử NaCl:
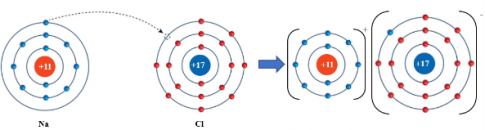
- Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion. Ở điều kiện thường, các hợp chất ion thường là tinh thể rắn, có nhiệt độ nóng chảy và nhiệt độ sôi cao.
3. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử. Liên kết cộng hóa trị thường gặp giữa phi kim với phi kim.
- Chú ý:
+ Nếu giữa hai nguyên tử có hai cặp electron dùng chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
+ Nếu giữa hai nguyên tử có ba cặp electron dùng chung thì ba cặp electron này được biểu diễn bằng một nối ba (≡) và gọi là liên kết ba.
+ Liên kết cho – nhận là liên kết cộng hóa trị mà cặp electron dùng chung được đóng góp từ một nguyên tử.
- Một số trường hợp ngoại lệ không tuân theo cách phân loại theo độ âm điện như: hợp chất cộng hóa trị HF, hợp chất ion MnI2, ...
- Trong liên kết giữa nguyên tử A và B, nếu độ âm điện của nguyên tử A nhỏ hơn độ âm điện của nguyên tử B thì cặp electron dùng chung sẽ bị lệch về phía nguyên tử B. Nguyên tử B lúc này mang một phần điện tích âm (δ−), nguyên tử A mang một phần điện tích dương (δ+). Liên kết này gọi là liên kết cộng hóa trị có cực.
- Liên kết cộng hóa trị được hình thành từ cặp electron dùng chung. Để tạo nên một cặp electron dùng chung, hai AO chứa electron độc thân (hoặc giữa một AO trống và 1 AO bão hòa electron) cần xen phủ với nhau.
- Xen phủ trục: là xen phủ giữa hai AO dọc theo trục nối (trục z) hai nguyên tử. Có ba khả năng xen phủ trục.
+ Xen phủ giữa AO s với AO s
+ Xen phủ giữa AO s với AO p
+ Xen phủ giữa AO p với AO p
- Xen phủ bên: là sự xen phủ xảy ra giữa hai AO p song song với nhau.
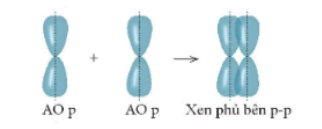
- Khi các nguyên tử liên kết với nhau sẽ tạo thành một hệ bền vững hơn, quá trình này giải phóng năng lượng. Do vậy, để phá vỡ liên kết giữa các nguyên tử thì phải cung cấp năng lượng.
4. Liên kết hydrogen và tương tác Van Der Waals
- Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Liên kết hydrogen thường được kí hiệu là dấu ba chấm (...), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
+ Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử tương đối bền vứng. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất.
+ Tại áp suất 1atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn của nước. Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
- Tương tác van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
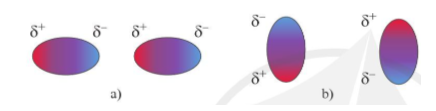
- Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính,... - Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính, ...

Bình luận