5 phút giải Hóa học 12 Chân trời sáng tạo trang 91
5 phút giải Hóa học 12 Chân trời sáng tạo trang 91. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 17. NGUYÊN TỐ NHÓM IA
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
MỞ ĐẦU
Pháo hoa thường được sử dụng trong các dịp lễ, Tết. Để tạo màu cho pháo hoa, người ta dùng một số muối hay oxide kim loại, trong đó có hợp chất kim loại nhóm IA như lithium carbonate tạo màu đỏ, sodium nitrate tạo màu vàng,…
Kim loại nhóm IA và hợp chất của chúng có những tính chất và ứng dụng nào?
A. ĐƠN CHẤT
1. VỊ TRÍ, CẤU TẠO VÀ TRẠNG THÁI TỰ NHIÊN
Thảo luận 1: Dựa vào cấu hình electron và bán kính nguyên tử (Bảng 17.1), hãy giải thích trong các hợp chất, kim loại nhóm IA đều thể thể hiện số oxi hoá +1.
Thảo luận 2: Giải thích tại sao trong tự nhiên kim loại nhóm IA chỉ tồn tại ở dạng hợp chất.
2. TÍNH CHẤT VẬT LÍ
Thảo luận 3: Dựa vàng Bảng 17.2, nêu xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các kim loại nhóm IA từ Li đến Cs.
Luyện tập: Vì sao kim loại nhóm IA có khối lượng riêng nhỏ và độ cứng thấp?
3. TÍNH CHẤT HOÁ HỌC
Thảo luận 4: Dựa vào cấu hình electron nguyên tử và giá trị thế điện cực chuẩn, dự đoán tính chất hoá học đặc trưng của kim loại nhóm IA.
Thảo luận 5: Khi cắt mẩu sodium ở trong không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi. Giải thích. Hãy dự đoán hiện tượng xảy ra khi cắt kim loại lithium, potassium trong không khí.
Luyện tập: Viết phương trình hoá học của các phản ứng sau (viết tên sản phẩm):
a) Li + O2 →
b) Na + Cl2 →
c) K + Br2 →
Thảo luận 6: Tại sao để bảo quản kim loại Na, K người ta ngâm chúng trong dầu hoả? Li có dùng cách này được không? Giải thích.
Thảo luận 7: Kim loại nhóm IA hoạt động hoá học mạnh. Tại sao?
B. HỢP CHẤT
1. TÍNH TAN CỦA CÁC HỢP CHẤT KIM LOẠI NHÓM IA
Thảo luận 8: Kim loại nhóm IA phản ứng dễ dàng với oxygen và nước, mức độ mãnh liệt của phản ứng tăng dần từ Li đến K. Giải thích.
Thảo luận 9: Quan sát thí nghiệm thử màu ngọn lửa, nêu hiện tượng quan sát được. Rút ra kết luận.
Luyện tập: Dung dịch của mỗi chất sau đều không màu: NaCl, Na2SO4, KCl, LiNO3. Hãy đề xuất cách phân biệt các dung dịch trên.
3. SODIUM CHLORIDE
4. ĐIỆN PHÂN DUNG DỊCH SODIUM CHLORIDE
Thảo luận 10: Sử dụng sơ đồ tư duy, trình bày các sản phẩm cơ bản của công nghiệp chlorine – kiềm và những ứng dụng quan trọng của chúng.
Thảo luận 11: Giải thích tại sao NaHCO3 được dùng làm bột nở.
Vận dụng: NaHCO3 dùng để tạo bọt và tăng pH trong các loại thuốc sủi bọt. Hãy tìm hiểu và giải thích.
Thảo luận 12: Vì sao phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia. Nêu những ưu điểm của phương pháp.
Luyện tập: Hãy vẽ sơ đồ tổng hợp Na2CO3 theo phương pháp Solvay.
BÀI TẬP
Câu hỏi 1: Phương pháp điều chế NaOH trong công nghiệp là
A. cho kim loại Na tác dụng với nước.
B. cho Na2O tác dụng với nước.
C. điện phân dung dịch NaCl bão hoà có màng ngăn.
D. điện phân dung dịch NaCl bão hoà, không có màng ngăn.
Câu hỏi 2: Viết phương trình hoá học của phản ứng khi cho potassium tác dụng với chlorine. Sản phẩm của phản ứng có tan tốt trong nước không? Tìm hiểu một số ứng dụng của nó.
Câu hỏi 3: Viết phương trình hoá học của phản ứng xảy ra trong các thí nghiệm sau:
a) Cho một mẩu kim loại sodium vào cốc nước.
b) Sục khí CO2 vào dung dịch KOH.
c) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn Na2CO3.
d) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn KHCO3.
e) Cho một lượng NaHCO3 rắn vào ống nghiệm rồi đun nóng trên ngọn lửa đèn cồn.
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
MỞ ĐẦU
Đáp án: - Tính chất: R lớn, D nhỏ, nhiệt độ nóng chảy, nhiệt độ sôi và độ cứng tương đối thấp, tính khử mạnh nhất, mức độ tăng dần từ Li đến Cs.
- Tồn tại dạng hợp chất, dễ tan trong nước, nhận biết bằng màu ngọn lửa.
- Sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,…
A. ĐƠN CHẤT
1. VỊ TRÍ, CẤU TẠO VÀ TRẠNG THÁI TỰ NHIÊN
Đáp án TL1: Vì cấu hình electron của các kim loại này đều có 1 electron lớp ngoài cùng nên nó dễ dàng nhường 1 electron này đi để đạt trạng thái bão hoà.
Đáp án TL2: Vì đây là những kim loại hoạt động rất mạnh. Khi ở ngoài môi trường không khí, các kim loại này dễ dàng tác dụng với xung quanh tạo thành hợp chất.
2. TÍNH CHẤT VẬT LÍ
Đáp án TL3: Giảm dần
Đáp án LT: - Khối lượng riêng nhỏ vì bán kính lớn, cấu trúc mạng tinh thể kém đặc khít.
- Độ cứng thấp vì liên kết kim loại yếu.
3. TÍNH CHẤT HOÁ HỌC
Đáp án TL4: Khử mạnh.
Đáp án TL5: - Vì sodium đã bị oxi hoá bởi O2 và H2O tạo thành các hỗn hợp chất rắn
- Hiện tượng: bề mặt vừa cắt có ánh kim lập tức mờ đi.
Đáp án LT: a) 2Li2O (lithium oxide) / b) 2NaCl (sodium chloride)
c) 2KBr (potassium bromide)
Đáp án TL6: - Vì Na, K phản ứng mạnh với nước ở điều kiện thường.
- Không thể dùng vì Li gặp dầu hoả sẽ nổi lên và bốc cháy.
Đáp án TL7: Vì đều có 1 electron lớp ngoài cùng nên có xu hướng mất đi một electron để biến thành ion dương.
B. HỢP CHẤT
1. TÍNH TAN CỦA CÁC HỢP CHẤT KIM LOẠI NHÓM IA
Đáp án TL8: Vì tính oxi hoá của các kim loại tăng dần từ Li đến K.
Đáp án TL9: + Muối Li: đỏ tía; Muối Na: màu vàng; Muối K: tím nhạt.
- Kết luận: nhận biết bằng màu ngọn lửa.
Đáp án LT: - Đốt cháy: muối Na màu vàng; muối K tím nhạt và muối Li đỏ tía.
- Cho BaCl2 vào ống nghiệm:
+ Tủa trắng: Na2SO4
+ Không hiện tượng: NaCl
PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
3. SODIUM CHLORIDE
4. ĐIỆN PHÂN DUNG DỊCH SODIUM CHLORIDE
Đáp án TL10:
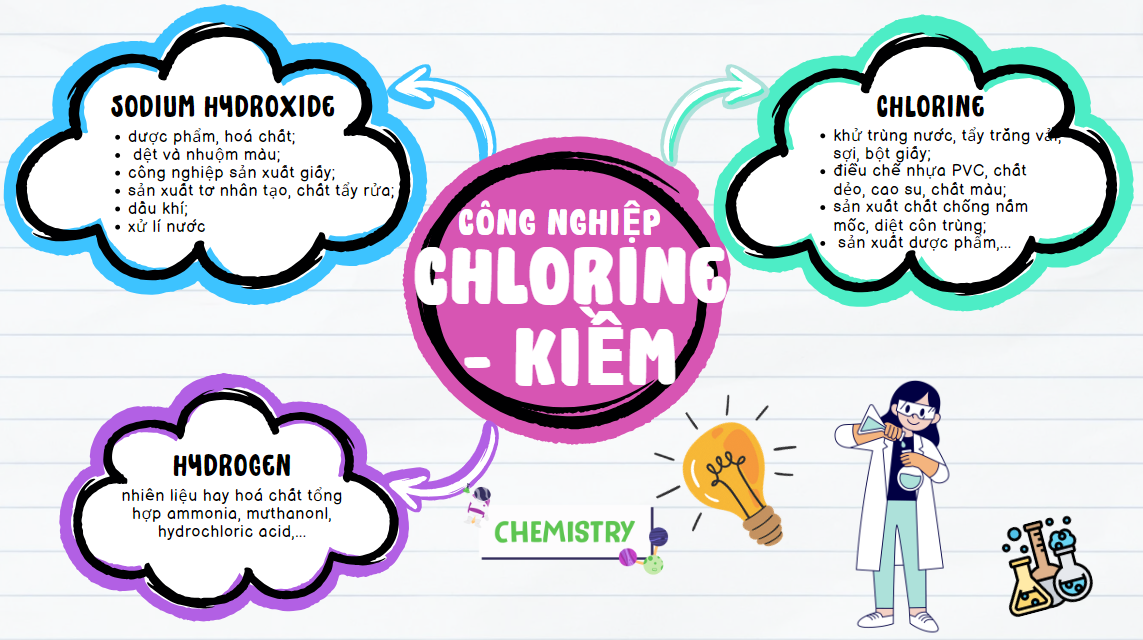
Đáp án TL11: Vì nhiệt độ cao, NaHCO3 dễ bị nhiệt phân, sinh ra chất khí và hơi làm tăng thể tích và tạo độ xốp cho bánh.
Đáp án VD: - NaHCO3 tiếp xúc acid, tạo ra khí CO2, giúp hấp thụ thuốc nhanh và hiệu quả hơn.
- NaHCO3 khi tan trong nước tạo thành NaOH, giúp làm dịu acid trong dạ dày.
Đáp án TL12: - Vì ammonia được tái sử dụng liên tục, không tiêu hao hoặc thoát ra môi trường.
- Ưu:
+ Nguyên liệu muối ăn, đá vôi, rẻ tiền, sẵn có, dễ thực hiện.
+ Thu hồi tối đa các khí nguyên liệu NH3, CO2; bảo đảm không thoát ra môi trường, giữ môi trường sạch.
+ Chất lượng cao, thỏa mãn nhiều nhu cầu
Đáp án LT: CaCO3![]() CO2
CO2
NaCl ![]() NaHCO3
NaHCO3 ![]() Na2CO3 (soda)
Na2CO3 (soda)
BÀI TẬP
Đáp án CH1: C
Đáp án CH2: - 2K + Cl2 → 2KCl
-Có tan tốt.
+ Làm phân bón, là nguyên liệu cung cấp K cho cây trồng.
+ Chất ổn định.
+ Bào chế thuốc và thuốc tiêm.
+ Là thành phần trong bình chữa cháy, đặc biệt là bình chữa cháy khô.
+ Công nghiệp dầu khí, công nghiệp cao su, mạ điện,…
Đáp án CH3:
a) 2Na + 2H2O → 2NaOH + H2
b) CO2 + 2KOH → K2CO3 + H2O / CO2 + KOH → KHCO3
c) Na2CO3 +HCl → NaCl + CO2 + H2O
d) KHCO3 + HCl → KCl + CO2 + H2O
e) 2NaHCO3 ![]() Na2CO3 + CO2 + H2
Na2CO3 + CO2 + H2
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 12 Chân trời sáng tạo, giải Hóa học 12 Chân trời sáng tạo trang 91, giải Hóa học 12 CTST trang 91
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận