Đáp án Hoá học 12 chân trời Bài 17: Nguyên tố nhóm IA
Đáp án Bài 17: Nguyên tố nhóm IA. Bài giải được trình bày ngắn gọn, chính xác giúp các em học Hóa học 12 chân trời dễ dàng. Từ đó, hiểu bài và vận dụng vào các bài tập khác. Đáp án chuẩn chỉnh, rõ ý, dễ tiếp thu. Kéo xuống dưới để xem chi tiết
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 17. NGUYÊN TỐ NHÓM IA
MỞ ĐẦU

Pháo hoa thường được sử dụng trong các dịp lễ, Tết. Để tạo màu cho pháo hoa, người ta dùng một số muối hay oxide kim loại, trong đó có hợp chất kim loại nhóm IA như lithium carbonate tạo màu đỏ, sodium nitrate tạo màu vàng,…
Kim loại nhóm IA và hợp chất của chúng có những tính chất và ứng dụng nào?
Đáp án chuẩn:
- Tính chất: bán kính nguyên tử lớn, khối lượng riêng nhỏ, nhiệt độ nóng chảy, nhiệt độ sôi và độ cứng tương đối thấp, tính khử mạnh nhất, mức độ tăng dần từ Li đến Cs.
- Tồn tại dạng hợp chất, dễ tan trong nước, nhận biết bằng màu ngọn lửa.
- Sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,…
A. ĐƠN CHẤT
1. VỊ TRÍ, CẤU TẠO VÀ TRẠNG THÁI TỰ NHIÊN
Thảo luận 1: Dựa vào cấu hình electron và bán kính nguyên tử (Bảng 17.1), hãy giải thích trong các hợp chất, kim loại nhóm IA đều thể thể hiện số oxi hoá +1.
Đáp án chuẩn:
Trong các hợp chất, kim loại nhóm IA đều thể hiện số oxi hoá +1 vì cấu hình electron của các kim loại này đều có 1 electron lớp ngoài cùng nên nó dễ dàng nhường 1 electron này đi để đạt trạng thái bão hoà.
Thảo luận 2: Giải thích tại sao trong tự nhiên kim loại nhóm IA chỉ tồn tại ở dạng hợp chất.
Đáp án chuẩn:
Trong tự nhiên kim loại nhóm IA chỉ tồn tại ở dạng hợp chất vì đây là những kim loại hoạt động rất mạnh. Khi ở ngoài môi trường không khí, các kim loại này dễ dàng tác dụng với xung quanh tạo thành hợp chất.
2. TÍNH CHẤT VẬT LÍ
Thảo luận 3: Dựa vàng Bảng 17.2, nêu xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các kim loại nhóm IA từ Li đến Cs.
Đáp án chuẩn:
Giảm dần
Luyện tập: Vì sao kim loại nhóm IA có khối lượng riêng nhỏ và độ cứng thấp?
Đáp án chuẩn:
- Khối lượng riêng nhỏ vì bán kính lớn, cấu trúc mạng tinh thể kém đặc khít.
- Độ cứng thấp vì liên kết kim loại yếu.
3. TÍNH CHẤT HOÁ HỌC
Thảo luận 4: Dựa vào cấu hình electron nguyên tử và giá trị thế điện cực chuẩn, dự đoán tính chất hoá học đặc trưng của kim loại nhóm IA.
Đáp án chuẩn:
Khử mạnh.
Thảo luận 5: Khi cắt mẩu sodium ở trong không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi. Giải thích. Hãy dự đoán hiện tượng xảy ra khi cắt kim loại lithium, potassium trong không khí.
Đáp án chuẩn:
- Vì sodium đã bị oxi hoá bởi O2 và H2O tạo thành các hỗn hợp chất rắn
- Hiện tượng: bề mặt vừa cắt có ánh kim lập tức mờ đi.
Luyện tập: Viết phương trình hoá học của các phản ứng sau (viết tên sản phẩm):
a) Li + O2 →
b) Na + Cl2 →
c) K + Br2 →
Đáp án chuẩn:
a) 2Li2O (lithium oxide)
b) 2NaCl (sodium chloride)
c) 2KBr (potassium bromide)
Thảo luận 6: Tại sao để bảo quản kim loại Na, K người ta ngâm chúng trong dầu hoả? Li có dùng cách này được không? Giải thích.
Đáp án chuẩn:
- Vì Na, K phản ứng mạnh với nước ở điều kiện thường.
- Không thể dùng vì Li gặp dầu hoả sẽ nổi lên và bốc cháy.
Thảo luận 7: Kim loại nhóm IA hoạt động hoá học mạnh. Tại sao?
Đáp án chuẩn:
Vì đều có 1 electron lớp ngoài cùng nên có xu hướng mất đi một electron để biến thành ion dương.
B. HỢP CHẤT
1. TÍNH TAN CỦA CÁC HỢP CHẤT KIM LOẠI NHÓM IA
Thảo luận 8: Kim loại nhóm IA phản ứng dễ dàng với oxygen và nước, mức độ mãnh liệt của phản ứng tăng dần từ Li đến K. Giải thích.
Đáp án chuẩn:
Vì tính oxi hoá của các kim loại tăng dần từ Li đến K.
Thảo luận 9: Quan sát thí nghiệm thử màu ngọn lửa, nêu hiện tượng quan sát được. Rút ra kết luận.
Đáp án chuẩn:
+ Muối Li: đỏ tía.
+ Muối Na: màu vàng.
+ Muối K: tím nhạt.
- Kết luận: nhận biết bằng màu ngọn lửa.
Luyện tập: Dung dịch của mỗi chất sau đều không màu: NaCl, Na2SO4, KCl, LiNO3. Hãy đề xuất cách phân biệt các dung dịch trên.
Đáp án chuẩn:
- Đốt cháy: muối Na màu vàng; muối K tím nhạt và muối Li đỏ tía.
- Cho BaCl2 vào ống nghiệm:
+ Tủa trắng: Na2SO4
+ Không hiện tượng: NaCl
PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
3. SODIUM CHLORIDE
4. ĐIỆN PHÂN DUNG DỊCH SODIUM CHLORIDE
Thảo luận 10: Sử dụng sơ đồ tư duy, trình bày các sản phẩm cơ bản của công nghiệp chlorine – kiềm và những ứng dụng quan trọng của chúng.
Đáp án chuẩn:
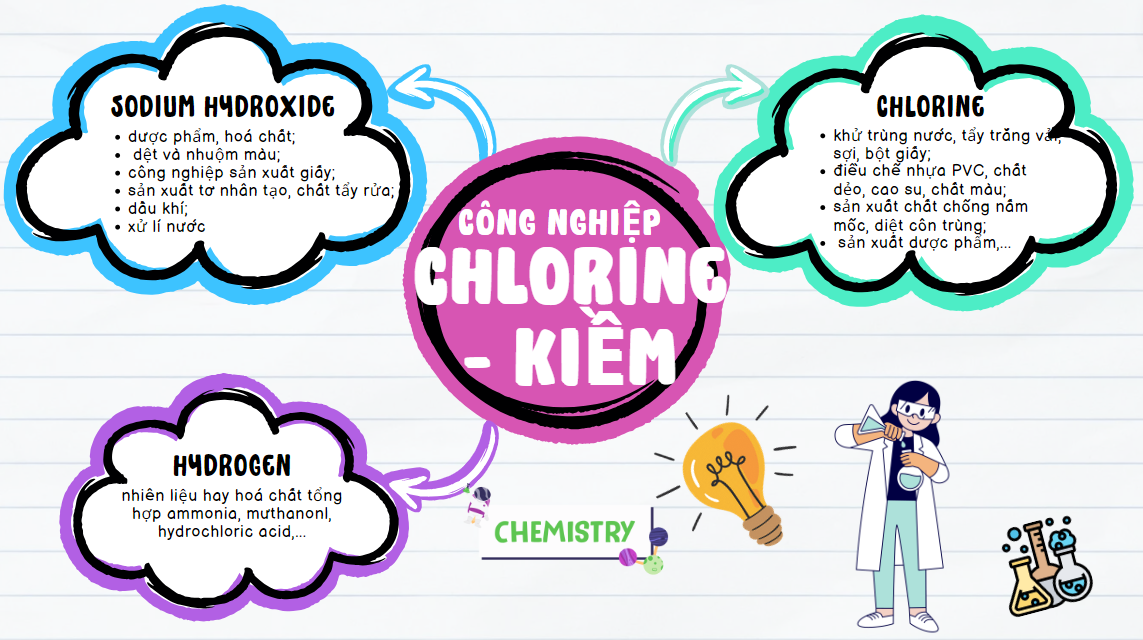
Thảo luận 11: Giải thích tại sao NaHCO3 được dùng làm bột nở.
Đáp án chuẩn:
Vì nhiệt độ cao, NaHCO3 dễ bị nhiệt phân, sinh ra chất khí và hơi làm tăng thể tích và tạo độ xốp cho bánh.
Vận dụng: NaHCO3 dùng để tạo bọt và tăng pH trong các loại thuốc sủi bọt. Hãy tìm hiểu và giải thích.
Đáp án chuẩn:
- NaHCO3 tiếp xúc acid, tạo ra khí CO2, tăng diện tích tiếp xúc giữa thuốc và dạ dày khi dùng, giúp hấp thụ thuốc nhanh và hiệu quả hơn.
- NaHCO3 khi tan trong nước tạo thành NaOH, giúp làm dịu acid trong dạ dày, giảm cảm giác khó chịu hoặc đau do acid.
Thảo luận 12: Vì sao phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia. Nêu những ưu điểm của phương pháp.
Đáp án chuẩn:
- Vì ammonia được tái sử dụng liên tục, không tiêu hao hoặc thoát ra môi trường.
- Ưu:
+ Nguyên liệu muối ăn, đá vôi, rẻ tiền, sẵn có, dễ thực hiện.
+ Thu hồi tối đa các khí nguyên liệu NH3, CO2; bảo đảm không thoát ra môi trường, giữ môi trường sạch.
+ Chất lượng cao, thỏa mãn nhiều nhu cầu
Luyện tập: Hãy vẽ sơ đồ tổng hợp Na2CO3 theo phương pháp Solvay.
Đáp án chuẩn:
NaCl ![]() NaHCO3
NaHCO3![]() Na2CO3 (soda)
Na2CO3 (soda) ![]()
CaCO3 ![]() CO2
CO2
BÀI TẬP
Bài 1: Phương pháp điều chế NaOH trong công nghiệp là
A. cho kim loại Na tác dụng với nước.
B. cho Na2O tác dụng với nước.
C. điện phân dung dịch NaCl bão hoà có màng ngăn.
D. điện phân dung dịch NaCl bão hoà, không có màng ngăn.
Đáp án chuẩn:
C
Bài 2: Viết phương trình hoá học của phản ứng khi cho potassium tác dụng với chlorine. Sản phẩm của phản ứng có tan tốt trong nước không? Tìm hiểu một số ứng dụng của nó.
Đáp án chuẩn:
- 2K + Cl2 → 2KCl
-Có tan tốt.
+ Làm phân bón, là nguyên liệu cung cấp K cho cây trồng.
+ Chất ổn định.
+ Bào chế thuốc và thuốc tiêm.
+ Là thành phần trong bình chữa cháy, đặc biệt là bình chữa cháy khô.
+ Công nghiệp dầu khí, công nghiệp cao su, mạ điện,…
Bài 3: Viết phương trình hoá học của phản ứng xảy ra trong các thí nghiệm sau:
a) Cho một mẩu kim loại sodium vào cốc nước.
b) Sục khí CO2 vào dung dịch KOH.
c) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn Na2CO3.
d) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn KHCO3.
e) Cho một lượng NaHCO3 rắn vào ống nghiệm rồi đun nóng trên ngọn lửa đèn cồn.
Đáp án chuẩn:
a) 2Na + 2H2O → 2NaOH + H2
b)
CO2 + 2KOH → K2CO3 + H2O
CO2 + KOH → KHCO3
c) Na2CO3 +HCl → NaCl + CO2 + H2O
d) KHCO3 + HCl → KCl + CO2 + H2O
e) 2NaHCO3 ![]() Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận