Đề cương ôn tập Hóa học 7 chân trời sáng tạo học kì 2
Đề cương ôn tập môn Hóa học lớp 7 bộ sách Chân trời sáng tạo mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 7. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 2 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ 2: PHÂN TỬ
1. PHÂN TỬ - ĐƠN CHẤT - HỢP CHẤT
a) Phân tử
- Phân tử là hạt đại diện cho chất, gồm một số nguyên tử kết hợp với nhau và thể hiện đầy đủ tính chất hóa học của chất.
- Có 2 dạng phân tử: Phân tử tạo bởi một nguyên tố và phân tử tạo bởi nhiều nguyên tố.
+ Phân tử tạo bởi một nguyên tố:
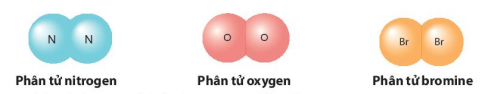
+ Phân tử tạo bởi nhiều nguyên tố:
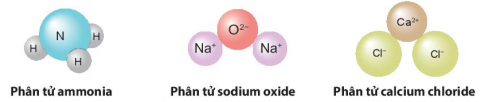
- Các nguyên tố khí hiếm (He, Ne, Ar, …) và kim loại đều là dạng đặc biệt của phân tử.
- Khối lượng phân tử của một chất là khối lượng tính bằng đơn vị amu của một phân tử chất đó.
- Khối lượng phân tử bằng tổng khối lượng các nguyên tử có trong phân tử.
b) Đơn chất
- Đơn chất là chất được tạo nên từ một nguyên tố hóa học.
- Một nguyên tố có thể tạo ra nhiều dạng đơn chất. Ví dụ: nguyên tố carbon (C) tạo nên than (than muội, than cốc, than gỗ, …), graphite, kim cương, …
c) Hợp chất
- Phân tử hợp chất gồm nhiều nguyên tố hóa học tạo nên.
- Trong hợp chất, nguyên tử của các nguyên tố kết hợp với nhau theo tỉ lệ và thứ tự nhất định.
2. LIÊN KẾT HÓA HỌC
a) Vỏ nguyên tử khí hiếm
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng có 2 electron.
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hóa học kém. Gồm: helium (He); neon (Ne); argon (Ar); krypton (Kr); xenon (Xe), …
- Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng nhường hoặc nhận hoặc góp chung electron.
+ Nguyên tử của các nguyên tố kim loại thường có khuynh hướng nhường electron ở lớp ngoài cùng.
+ Nguyên tử của các nguyên tố phi kim thường có khuynh hướng nhận thêm hoặc góp chung electron để có lớp electron ngoài cùng bền vững.
b) Liên kết ion
- Liên kết ion là liên kết giữa ion dương và ion âm.
- Các ion dương và ion âm đơn nguyên tử có lớp electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
c) Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử.
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim với phi kim.
d) Chất ion, chất cộng hóa trị
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
- Chất được tạo thành nhờ liên kết cộng hóa trị được gọi là chất cộng hóa trị.
Bảng so sánh một số tính chất của chất ion với chất cộng hóa trị
Tính chất | Chất ion | Chất cộng hóa trị |
Trạng thái (ở điều kiện thường) | Thể rắn | Cả ba thể (rắn, lỏng, khí) |
Nhiệt độ sôi, nhiệt độ nóng chảy | Cao | Thấp |
Dẫn điện | Tan trong nước tạo dung dịch dẫn được điện | Nhiều chất không dẫn điện (đường ăn, ethanol,…) |
3. HÓA TRỊ VÀ CÔNG THỨC HÓA HỌC
a) Hóa trị
- Hóa trị của một nguyên tố trong hợp chất là con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử khác trong phân tử.
- Hóa trị được biểu thị bằng các chữ số La Mã (I; II …)
- Quy tắc hóa trị: Trong phân tử hợp chất hai nguyên tố, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
Ví dụ: Trong phân tử aluminium chlorine (AlCl3), hóa trị và số nguyên tử tham gia liên kết của Al và Cl như sau:
Nguyên tố | Al | Cl |
Hóa trị | III | I |
Số nguyên tử | 1 | 3 |
Tích hóa trị và số nguyên tử | III × 1 = I × 3 | |
b) Công thức hóa học
- Công thức hóa học dùng để biểu diễn chất, gồm một hoặc nhiều kí hiệu nguyên tố và chỉ số ở phía dưới, bên phải kí hiệu.
- Công thức chung của phân tử có dạng AxBy.
- Công thức hóa học cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố có trong phân tử đó. Từ đó có thể tính được khối lượng phân tử.
- Với hợp chất AxBy, ta có: $\%A=\frac{KLNT(A).x}{KLPT(A_{x}B_{y})}.100\%$
- Tổng tất cả các phần trăm nguyên tố trong một phân tử luôn bằng 100%.
c) Xác định công thức hóa học:
| Lập công thức hóa học của hợp chất theo phần trăm các nguyên tố và khối lượng phân tử | Lập công thức hóa học dựa vào quy tắc hóa trị |
Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát); Bước 2: Lập biểu thức tính phần trăm nguyên tố có trong hợp chất. Bước 3: Xác định số nguyên tử của mỗi nguyên tố và viết công thức hóa học cần tìm. | Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát) Bước 2: Lập biểu thức tính dựa vào quy tắc hóa trị, chuyển thành tỉ lệ các chỉ số nguyên tử. Bước 3: Xác định số nguyên tử (những số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hóa học cần tìm. |
Ví dụ: Thạch nhũ trong hang động có thành phần chính là hợp chất (T). Phân tử (T) có cấu tạo từ nguyên tố calcium, carbon và oxygen với các tỉ lệ phần trăm tương ứng là 40%, 12% và 48%. Khối lượng phân tử (T) là 100 amu. Hãy xác định công thức hóa học của (T). Bước 1: Đặt công thức của hợp chất là: CaxCyOz Bước 2 + 3: Phần trăm các nguyên tố có trong hợp chất là: $\%Ca=\frac{40.x.100\%}{100}=40\%\Rightarrow x=1$ $\%C=\frac{12.y.100\%}{100}=12\%\Rightarrow y=1$ $\%O=\frac{16.z.100\%}{100}=48\%\Rightarrow z=3$ Vậy công thức của hợp chất là CaCO3 | Ví dụ: Lập công thức hóa học của hợp chất tạo bởi lưu huỳnh có hóa trị IV và oxygen Bước 1: Đặt công thức hóa học của hợp chất là: $S^{IV}_{x}O^{II}_{y}$ Bước 2: Theo quy tắc hóa trị: x.IV = y.II $\Rightarrow \frac{x}{y}=\frac{II}{IV}=\frac{1}{2}$ Bước 3: Chọn x = 1 và y = 2. Vậy công thức hóa học của hợp chất là SO2 |

Bình luận