Trắc nghiệm Hóa học 10 Kết nối tri thức Ôn tập chương 1: Cấu tạo nguyên tử (Phần 2)
Bài trắc nghiệm có đáp án. Câu hỏi và bài tập trắc nghiệm Hóa học 10 Ôn tập chương 1: Cấu tạo nguyên tử (Phần 2) - sách kết nối tri thức. Học sinh luyện tập bằng cách chọn đáp án của mình trong từng câu hỏi. Dưới cùng của bài trắc nghiệm, có phần xem kết quả để biết bài làm của mình. Kéo xuống dưới để bắt đầu.
ÔN TẬP CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ
Câu 1: Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây
A. Nguyên lí bền vững và quy tắc Hund.
- B. Nguyên lí bền vững và nguyên lí loại trừ Pauli.
- C. Nguyên lí loại trừ Pauli và quy tắc Hund.
- D. Nguyên lí bền vững và quy tắc loại trừ Pauli.
Câu 2: Cấu hình electron lớp ngoài cùng của 2 nguyên tử A và B lần lượt là ![]() và
và ![]() . Biết rằng phân lớp 3s của 2 nguyên tử A và B có số electron bằng nhau. Hai nguyên tố A, B lần lượt là
. Biết rằng phân lớp 3s của 2 nguyên tử A và B có số electron bằng nhau. Hai nguyên tố A, B lần lượt là
- A. Na và Cl.
B. Mg và Cl.
- C. Na và S.
- D. Mg và S.
Câu 3: Nguyên tử X có tổng số proton, neutron, electron là 52 và số khối là 35. Cấu hình electron của X là
- A.
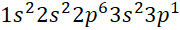
- B.

- C.
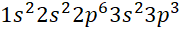
D.
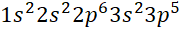
Câu 4: Ở ![]() khối lượng riêng của sắt là 7,85
khối lượng riêng của sắt là 7,85 ![]() . Giả thiết trong tinh thể các nguyên tử sắt là những hình cầu chiếm 75% thể tích tinh thể, phần còn lại là các khe rỗng giữa các quả cầu và khối lượng nguyên tử sắt là 55,85 amu thì bán kính gần đúng của một nguyên tử sắt ở nhiệt độ này là
. Giả thiết trong tinh thể các nguyên tử sắt là những hình cầu chiếm 75% thể tích tinh thể, phần còn lại là các khe rỗng giữa các quả cầu và khối lượng nguyên tử sắt là 55,85 amu thì bán kính gần đúng của một nguyên tử sắt ở nhiệt độ này là
A. 1,28 Å.
- B. 2,56 Å.
- C. 2,34 Å.
- D. 1,54 Å.
Câu 5: Hợp chất Z được tạo bởi hai nguyên tố X và Y có công thức XY2 trong đó Y chiếm 72,73% về khối lượng. Biết rằng trong phân tử Z, tổng số hạt (proton, neutron, electron) là 66, số proton là 22. Nguyên tố Y là
- A. Nitrogen.
B. Oxygen.
- C. Sulfur.
- D. Carbon.
Câu 6: Phát biểu nào sau đây không đúng
- A. Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định.
- B. Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
C. Có 3 loại orbital nguyên tử: orbital s, orbital p và orbital d.
- D. Orbital nguyên tử được kí hiệu là AO (Atomic Orbital).
Câu 7: Biết rằng nguyên tố argon có ba đồng vị khác nhau, ứng với số khối 36, 38 và A. Phần trăm số nguyên tử các đồng vị tương ứng lần lượt là 0,34%, 0,06% và 99,6%. Biết rằng nguyên tử khối trung bình của argon bằng 39,98, A bằng
- A. 39.
B. 40.
- C. 41.
- D. 37.
Câu 8: Đặc trưng cơ bản của một nguyên tử là
A. Số đơn vị điện tích hạt nhân và số khối.
- B. Số proton và số electron trong vỏ nguyên tử.
- C. Số đơn vị điện tích hạt nhân và số electron trong vỏ nguyên tử.
- D. Số neutron trong hạt nhân nguyên tử.
Câu 9: Thí nghiệm không được sử dụng để phát hiện ra cấu tạo của nguyên tử
- A. Thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt alpha.
- B. Thí nghiệm dùng hạt alpha bắn phá nitrogen.
- C. Thí nghiệm phóng điện qua không khí loãng.
D. Thí nghiệm dùng hạt alpha bắn phá neon.
Câu 10: Tổng số các hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 24. Số khối của nguyên tố X là
- A. 18.
B. 16.
- C. 8.
- D. 12.
Câu 11: Trong tự nhiên, oxygen có 3 đồng vị bền là ![]() ,
, ![]() ,
, ![]() . Có bao nhiêu loại phân tử O2
. Có bao nhiêu loại phân tử O2
- A. 12.
- B. 9.
C. 6.
- D. 3.
Câu 12: Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng
- A. Bất kì.
- B. Lần lượt từ cao đến thấp.
- C. Từ mức thứ hai trở đi.
D. Lần lượt từ thấp đến cao.
Câu 13: Đồng vị là
- A. Những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số neuton) nhưng có số proton khác nhau.
- B. Những nguyên tử có cùng số khối, cùng số proton nhưng có số neutron khác nhau.
- C. Những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số electron khác nhau.
D. Những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Câu 14: Nguyên tử X có 3 lớp electron, số electron ở lớp ngoài cùng là 5, các lớp trong đều đã bão hòa electron. Nguyên tử X thuộc loại nguyên tố nào, cho biết kí hiệu hóa học
- A. f, F.
- B. d, Co.
- C. s, S.
D. p, P.
Câu 15: Số hiệu nguyên tử cho biết thông tin nào sau đây
- A. Số khối.
- B. Số neutron.
- C. Nguyên tử khối.
D. Số proton.
Câu 16: Nguyên tử M có cấu hình electron ở phân lớp ngoài cùng là ![]() . Xác định M là kim loại, phi kim hay khí hiếm và cho biết số electron
. Xác định M là kim loại, phi kim hay khí hiếm và cho biết số electron
- A. Phi kim, 27.
- B. Kim loại, 36.
C. Kim loại, 27.
- D. Phi kim, 36.
Câu 17: Nguyên tử chứa những hạt mang điện là
- A. Electron và hạt alpha.
- B. Proton và neutron.
C. Proton và electron.
- D. Electron và neutron.
Câu 18: Khối lượng nguyên tử tập trung ở
A. Hạt nhân nguyên tử.
- B. Phân bố đều trên thể tích của nguyên tử.
- C. Lớp vỏ electron.
- D. Phân bố ngẫu nhiên trên thể tích của nguyên tử.
Câu 19: Vì sao trong bảng tuần hoàn các nguyên tố hóa học, giá trị nguyên tử khối của chromium (Cr) không phải là số nguyên mà là 51,996
- A. Vì giá trị nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng phân của nguyên tố đó.
- B. Vì giá trị nguyên tử khối của một nguyên tố là nguyên tử khối xấp xỉ các nguyên tử nguyên tố đó.
C. Vì giá trị nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
- D. Vì giá trị nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng đẳng của nguyên tố đó.
Câu 20: Chọn đáp án đúng
- A. Neutron, m ~ 1 amu, q = -1.
- B. Proton, m ~ 0,00055 amu, q = +1.
C. Electron, m ~ 0,00055 amu, q = -1.
- D. Proton, m ~ 1 amu, q = -1.
Câu 21: Dựa vào thứ tự mức năng lượng, xét xem sự sắp xếp các phân lớp nào sau đây không đúng
- A. 1s < 2s.
- B. 3d < 4s.
C. 3p < 3d.
- D. 4s > 3s.
Câu 22: Kí hiệu nguyên tử nào sau đây viết đúng
- A.
 .
. - B.
 .
. - C.
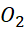 .
. D.
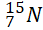 .
.
Câu 23: Trong tự nhiên đồng có 2 đồng vị bền là ![]() và
và ![]() . Nguyên tử khối trung bình của đồng là 63,546. Số nguyên tử
. Nguyên tử khối trung bình của đồng là 63,546. Số nguyên tử ![]() có trong 31,773g Cu là
có trong 31,773g Cu là
- A.
 .
. - B.
 .
. C.
 .
.- D.
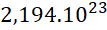 .
.
Câu 24: Lớp N có số phân lớp electron bằng
- A. 1.
- B. 2.
- C. 3.
D. 4.
Câu 25: Iodine rất cần thiết cho cơ thể, tham gia vào quá trình hình thành, phát triển cũng như duy trì hoạt động của con người. Nguyên tử idone chứa 53 electron và có số khối là 127. Tổng số hạt cơ bản trong nguyên tử iodine là
- A. 200.
- B. 184.
C. 180.
- D. 164.

Bình luận