Dễ hiểu giải hóa học 11 kết nối bài 24 Carboxylic acid
Giải dễ hiểu Dễ hiểu giải hóa học 11 kết nối bài 24 Carboxylic acid. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 11 Kết nối dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 24: CARBOXYLIC ACID
MỞ ĐẦU
Vị chua của giấm và các loại quả như khế, chanh, táo, me,.... đều được tạo bởi carboxylic acid. Vậy carboxylic acid chứa nhóm chức nào và có các tính chất đặc trưng gì?
Giải nhanh:
- Là các hợp chất hữu cơ trong phân tử có nhóm – COOH liên kết với nguyên tử carbon hoặc nguyên tử hydrogen.
- TCHH: tính acid và tham gia phản ứng ester hoá.
I. KHÁI NIỆM, DANH PHÁP
Hoạt động: Nhiều carboxylic acid tồn tại trong tự nhiên. Hãy nhận xét đặc điểm chung về cấu tạo của các carboxylic acid dưới đây
Giải nhanh:
Đều có nhóm –COOH liên kết với nguyên tử carbon hoặc nguyên tử hydrogen.
Câu hỏi 1: Viết các công thức cấu tạo và gọi tên theo danh pháp thay thế của các acid có công thức C4H9COOH.
Giải nhanh:
CTCT | Tên gọi |
CH3-CH2-CH2-CH2-COOH | pentanoic acid |
CH3-CH(COOH)-CH2-CH3 | 2-methylbutanoic acid |
CH3-CH(CH3)-CH2-COOH | 3-methylbutanoic acid |
CH3C(CH3)2COOH | 2,2-dimethylpropanoic acid |
Câu hỏi 2: Viết công thức cấu tạo của các carboxylic acid có tên gọi dưới đây:
a) pentanoic acid; b) but-3-enoic acid;
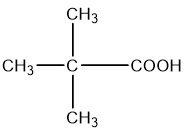
c) 2-methylbutanoic acid; d) 2,2-dimethylpropanoic acid.
Giải nhanh:
a) CH3-CH2-CH2-CH2-COOH
b) CH2=CH-CH2-COOH
c)
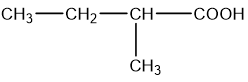
d)
II. ĐẶC ĐIỂM CẤU TẠO
III. TÍNH CHẤT VẬT LÍ
Hoạt động: Tại sao trong các hợp chất hữu cơ có phân tử khối xấp xỉ nhau dưới đây, carboxylic acid có nhiệt độ sôi cao nhất?
Loại hợp chất | alkane | aldehyde | alcohol | carboxylic acid |
Công thức cấu tạo | CH3CH2CH2CH3 | CH3CH2CHO | CH3CH2CH2OH | CH3COOH |
M | 58 | 58 | 60 | 60 |
ts (°C) | -0,5 | 49 | 97,2 | 118 |
Giải nhanh:
Vì nó chứa nhóm carboxyl phân cực. Các phân tử carboxylic acid liên kết hydrogen với nhau tạo thành dạng dimer hoặc dạng liên phân tử.
IV. TÍNH CHẤT HÓA HỌC
Hoạt động: Trong dung dịch nước, carboxylic acid phân li không hoàn toàn theo cân bằng:

Hằng số cân bằng của phương trình phân li một số carboxylic acid được cho trong Bȧng 24.3.
Bảng 24.3. Hằng số cân bằng của phương trình phân li một số carboxylic acid
Carboxylic acid | Hằng số cân bằng của phương trình phân li carboxylic acid | Phần trăm phần li (dung dịch 0,1 M) (%) |
HCOOH | 1,8.10−4 | 4,2 |
CH3COOH | 1,8.10−5 | 1,3 |
CH3CH2COOH | 1,3.10−5 | 1,2 |
| CH3CH2CH2COOH | 1,5.10−5 | 1,2 |
Hãy nhận xét về khả năng phân li của carboxylic acid. Chúng là các acid mạnh hay yếu và có các phản ứng đặc trưng nào?
Giải nhanh:
- Trong dung dịch, chỉ một phần nhỏ chúng phân li thành ion, vì vậy carboxylic acid là những acid yếu.
- Phản ứng với kim loại, oxide kim loại, muối, base.
Thí nghiệm: Tính acid của acetic acid
Chuẩn bị: dung dịch acetic acid 10%, dung dịch Na2CO3 10%, bột Mg; ống nghiệm, giấy qùy.
Tiến hành:
1. Phản ứng với chất chỉ thị:
Nhỏ một giọt dung dịch acetic acid 10% lên mẫu giấy qùy. Quan sát và mô tả sự thay đổi màu sắc của giấy quỳ.
2. Phản ứng với kim loại:
- Cho 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (1).
- Thêm tiếp một ít bột Mg vào ống nghiệm (1).
Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (1).
3. Phản ứng với muối:
- Cho 1 – 2 mL dung dịch Na2CO3 10% vào ống nghiệm (2).
- Thêm tiếp 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (2).
Thực hiện yêu cầu sau:
Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (2).
Viết phương trình hoá học của các phản ứng xảy ra trong các thí nghiệm trên và giải thích hiện tượng.
Giải nhanh:
1. Quỳ tím chuyển đỏ vì có acetic acid.
2. Kim loại tan và có khí không màu thoát ra. PTHH:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
3. Tạo dung dịch không màu và có khí thoát ra. PTHH:
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
Câu hỏi 3: Viết phương trình hoá học phản ứng giữa acetic acid với các chất sau:
a) Ca; b) Cu(OH)2; c) CaO; d) K2CO3.
Giải nhanh:
a) 2CH3COOH + Ca → (CH3COO)2Ca + H2↑
b) 2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
c) 2CH3COOH + CaO → (CH3COO)2Ca + H2O
d) 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O
Câu hỏi 4: a) Khi có cặn màu trắng (thành phần chính là CaCO3) bám ở đáy ấm đun nước, vòi nước, thiết bị vệ sinh,... có thể dùng giấm để loại bỏ các vết cặn này. Hãy giải thích.
b) Các đồ vật bằng đồng sau một thời gian để trong không khí thường bị xỉn màu, dùng khăn tầm một ít giấm rồi lau các đồ vật này, chúng sáng bóng trở lại. Hãy giải thích.
Giải nhanh:
a) Vì giấm chứa acetic acid sẽ hoà tan CaCO3. PTHH:
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
b) Vì đồng bị oxi hoá bởi O2 trong không khí, tạo gỉ đồng. Dùng giấm vì acetic acid phản ứng với CuO trong gỉ đồng.
2CH3COOH + CuO → (CH3COO)2Cu + H2O
Hoạt động: Phản ứng ester hoá - điều chế ethyl acetate
Điều chế ethyl acetate trong phòng thí nghiệm được tiến hành như sau:
- Cho khoảng 2 mL ethanol và 2 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp.
- Thêm khoảng 1 mL dung dịch H2SO4 đặc, lắc nhẹ để các chất trộn đều với nhau.
- Kẹp ống nghiệm vào kẹp gỗ rồi đặt ống nghiệm vào cốc nước nóng (khoảng 60°C - 70°C) trong khoảng 5 phút, thỉnh thoảng lắc đều hỗn hợp. Sau đó lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 5 mL dung dịch muối ăn bão hoà.
Thực hiện yêu cầu:
1. Mô tả hiện tượng, viết phương trình hoá học của phản ứng ester hoá xảy ra trong thí nghiệm trên.
2. Vai trò của sulfuric acid trong thí nghiệm trên là gì?
Giải nhanh:
1. Dung dịch phân thành hai lớp và dung dịch có mùi thơm.
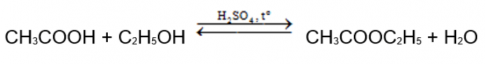
2. Vai trò là chất xúc tác.
Câu hỏi 5: Methyl butyrate là ester tạo mùi đặc trưng của quả táo, em hãy viết phương trình hoá học của phản ứng điều chế methyl butyrate từ carboxylic acid và alcohol tương ứng.
Giải nhanh:
![]()
Câu hỏi 6: Methyl salicylate là hợp chất thuộc loại ester được dùng làm cao dán giảm đau, kháng viêm ngoài da. Methyl salicylate được tổng hợp từ phản ứng ester hóa giữa salicylic acid và methanol. Hãy hoàn thành phương trình hoá học của phản ứng tổng hợp methyl salicylate:
Giải nhanh:
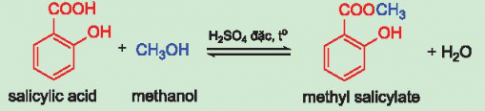
V. ĐIỀU CHẾ
VI. ỨNG DỤNG
Hoạt động: Em hãy tìm hiểu và trình bày ứng dụng của một carboxylic acid.
Giải nhanh:
- Vinyl acetate: sản xuất keo dán và chất kết dính trong sản xuất giấy, sản xuất tơ (tơ vinylon),...
- Cellulose acetate: tá dược trong sản xuất thuốc, sản xuất tơ, phim ảnh,...
- Acetic acid: tổng hợp aluminium monoacetate làm chất cầm màu trong công nghiệp dệt may, tổng hợp ethyl acetate, butyl acetate làm dung môi,...
- Dung dịch acetic acid 2 - 5%: làm giấm ăn, làm chất tẩy cặn trong siêu đun nước…
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận