5 phút giải Hóa học 11 Kết nối tri thức trang 145
5 phút giải Hóa học 11 Kết nối tri thức trang 145. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
CHƯƠNG 6. HỢP CHẤT CARBONYL - CARBOXYLIC ACID
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Vị chua của giấm và các loại quả như khế, chanh, táo, me,.... đều được tạo bởi carboxylic acid. Vậy carboxylic acid chứa nhóm chức nào và có các tính chất đặc trưng gì?
1. KHÁI NIỆM, DANH PHÁP
Bài 1: Nhiều carboxylic acid tồn tại trong tự nhiên. Hãy nhận xét đặc điểm chung về cấu tạo của các carboxylic acid dưới đây...
Bài 2: Viết các công thức cấu tạo và gọi tên theo danh pháp thay thế của các acid có công thức C4H9COOH.
Bài 3: Viết công thức cấu tạo của các carboxylic acid có tên gọi dưới đây:
a) pentanoic acid;
b) but-3-enoic acid;
c) 2-methylbutanoic acid;
d) 2,2-dimethylpropanoic acid.
2. ĐẶC ĐIỂM CẤU TẠO
3. TÍNH CHẤT VẬT LÍ
Bài 1: Tại sao trong các hợp chất hữu cơ có phân tử khối xấp xỉ nhau dưới đây, carboxylic acid có nhiệt độ sôi cao nhất?
Loại hợp chất | alkane | aldehyde | alcohol | carboxylic acid |
Công thức cấu tạo | CH3CH2CH2CH3 | CH3CH2CHO | CH3CH2CH2OH | CH3COOH |
M | 58 | 58 | 60 | 60 |
ts (°C) | -0,5 | 49 | 97,2 | 118 |
4. TÍNH CHẤT HÓA HỌC
Bài 1: Trong dung dịch nước, carboxylic acid phân li không hoàn toàn theo cân bằng:

Hằng số cân bằng của phương trình phân li một số carboxylic acid được cho trong Bȧng 24.3.
Bảng 24.3. Hằng số cân bằng của phương trình phân li một số carboxylic acid
Carboxylic acid | Hằng số cân bằng của phương trình phân li carboxylic acid | Phần trăm phần li (dung dịch 0,1 M) (%) |
HCOOH | 1,8.10−4 | 4,2 |
CH3COOH | 1,8.10−5 | 1,3 |
CH3CH2COOH | 1,3.10−5 | 1,2 |
CH3CH2CH2COOH | 1,5.10−5 | 1,2 |
Hãy nhận xét về khả năng phân li của carboxylic acid. Chúng là các acid mạnh hay yếu và có các phản ứng đặc trưng nào?
Bài 2: Tính acid của acetic acid
Chuẩn bị: dung dịch acetic acid 10%, dung dịch Na2CO3 10%, bột Mg; ống nghiệm, giấy qùy.
Tiến hành:
1. Phản ứng với chất chỉ thị:
Nhỏ một giọt dung dịch acetic acid 10% lên mẫu giấy qùy. Quan sát và mô tả sự thay đổi màu sắc của giấy quỳ.
2. Phản ứng với kim loại:
- Cho 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (1).
- Thêm tiếp một ít bột Mg vào ống nghiệm (1).
Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (1).
3. Phản ứng với muối:
- Cho 1 – 2 mL dung dịch Na2CO3 10% vào ống nghiệm (2).
- Thêm tiếp 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (2).
Thực hiện yêu cầu sau:
Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (2).
Viết phương trình hoá học của các phản ứng xảy ra trong các thí nghiệm trên và giải thích hiện tượng.
Bài 3: Viết phương trình hoá học phản ứng giữa acetic acid với các chất sau:
a) Ca
b) Cu(OH)2
c) CaO
d) K2CO3
Bài 4: a) Khi có cặn màu trắng (thành phần chính là CaCO3) bám ở đáy ấm đun nước, vòi nước, thiết bị vệ sinh,... có thể dùng giấm để loại bỏ các vết cặn này. Hãy giải thích.
b) Các đồ vật bằng đồng sau một thời gian để trong không khí thường bị xỉn màu, dùng khăn tầm một ít giấm rồi lau các đồ vật này, chúng sáng bóng trở lại. Hãy giải thích.
Bài 5: Phản ứng ester hoá - điều chế ethyl acetate
Điều chế ethyl acetate trong phòng thí nghiệm được tiến hành như sau:
- Cho khoảng 2 mL ethanol và 2 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp.
- Thêm khoảng 1 mL dung dịch H2SO4 đặc, lắc nhẹ để các chất trộn đều với nhau.
- Kẹp ống nghiệm vào kẹp gỗ rồi đặt ống nghiệm vào cốc nước nóng (khoảng 60°C - 70°C) trong khoảng 5 phút, thỉnh thoảng lắc đều hỗn hợp. Sau đó lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 5 mL dung dịch muối ăn bão hoà.
Thực hiện yêu cầu:
1. Mô tả hiện tượng, viết phương trình hoá học của phản ứng ester hoá xảy ra trong thí nghiệm trên.
2. Vai trò của sulfuric acid trong thí nghiệm trên là gì?
Bài 6: Methyl butyrate là ester tạo mùi đặc trưng của quả táo, em hãy viết phương trình hoá học của phản ứng điều chế methyl butyrate từ carboxylic acid và alcohol tương ứng.
Bài 7: Methyl salicylate là hợp chất thuộc loại ester được dùng làm cao dán giảm đau, kháng viêm ngoài da. Methyl salicylate được tổng hợp từ phản ứng ester hóa giữa salicylic acid và methanol. Hãy hoàn thành phương trình hoá học của phản ứng tổng hợp methyl salicylate:

5. ĐIỀU CHẾ
6. ỨNG DỤNG
Bài 1: Em hãy tìm hiểu và trình bày ứng dụng của một carboxylic acid.
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
- Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm –COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc –COOH) hoặc nguyên tử hydrogen.
Chứa nhóm –COOH:
- Phản ứng ester hóa
- Tính acid
- Phản ứng halogen hoá
- Phản ứng khử
- Phản ứng tráng gương
1. KHÁI NIỆM, DANH PHÁP
Bài 1:
Có nhóm –COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc –COOH) hoặc nguyên tử hydrogen.
Bài 2:
STT | Đồng phân | Tên gọi |
1 | CH3-CH2-CH2-CH2-COOH | pentanoic acid |
2 | CH3-CH(COOH)-CH2-CH3 | 2-methylbutanoic acid |
3 | CH3-CH(CH3)-CH2-COOH | 3-methylbutanoic acid |
4 | CH3C(CH3)2COOH | 2,2-dimethylpropanoic acid |
Bài 3:
a) CH3-CH2-CH2-CH2-COOH
b) CH2=CH-CH2-COOH
c) 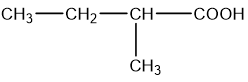
d) 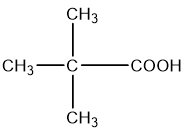
2. ĐẶC ĐIỂM CẤU TẠO
3. TÍNH CHẤT VẬT LÍ
Bài 1:
Do hình thành liên kết hydro giữa các phân tử carboxylic acid
4. TÍNH CHẤT HÓA HỌC
Bài 1:

Trong dung dịch, chỉ một phần nhỏ carboxylic acid phân li thành ion, vì vậy carboxylic acid là những acid yếu. Chúng thể hiện đầy đủ tính chất của acid: tác dụng với kim loại, oxide kim loại, muối, base.
Bài 2: Tính acid của acetic acid
1. Quỳ tím chuyển sang màu đỏ
2. Có khí thoát ra.
Mg + 2CH3COOH → (CH3COO)2Mg + H2
3. Có khí thoát ra.
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
Bài 3:
a) 2CH3COOH + Ca → (CH3COO)2Ca + H2 ↑
b) CH3COOH + Cu(OH)2 → (CH3COO)2Cu + H2O
c) 2CH3COOH + CaO → (CH3COO)2Ca + H2O
d) 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O
Bài 4:
a) Trong giấm ăn có acetic có khả năng tác dụng với CaCO3
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
b) Màu đồng xỉn dưới sự tác động của CO2 và hơi ẩm.
Cu + H2O + O2 + CO2 → CuCO3.Cu(OH)2
Chúng sáng bóng trở lại.
2CH3COOH + CuCO3 → (CH3COO)2Cu + CO2 + H2O
2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
Bài 5:
1. Hiện tượng: dung dịch phân thành hai lớp và có mùi thơm.
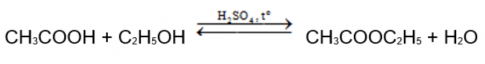
2. Xúc tác.
Bài 6:
CH3CH2CH2COOH + CH3OH → CH3CH2CH2COOCH3 + H2O
Bài 7:
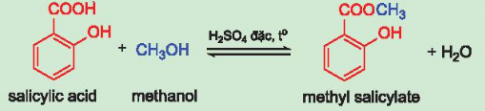
5. ĐIỀU CHẾ
6. ỨNG DỤNG
Bài 1:
Acrylic acid và methacrylic acid được dùng để sản xuất thuỷ tinh hữu cơ.
Benzoic acid với liều lượng nhỏ được dùng làm chất bảo quản thực phẩm. Salicylic acid được dùng sản xuất thuốc cảm aspirin, thuốc giảm đau methyl salicylate.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 11 Kết nối tri thức, giải Hóa học 11 Kết nối tri thức trang 145, giải Hóa học 11 KNTT trang 145
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận