Đề số 5: Đề kiểm tra hóa học 11 Kết nối bài 1 Khái niệm về cân bằng hóa học
III. DẠNG 3 – ĐỀ TRẮC NGHIỆM VÀ TỰ LUẬN
ĐỀ SỐ 5
I. Phần trắc nghiệm (4 điểm)
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1. Cho hệ phản ứng sau ở trạng thái cân bằng
2SO2(k) + O2(k) ⇌ 2SO3(k) ∆H < 0
Nồng độ của SO3 sẽ tăng lên khi
- A. giảm nồng độ của SO2
- B. tăng nồng độ của O2
- C. tăng nhiệt độ lên rất cao
- D. giảm nhiệt độ xuống rất thấp
Câu 2. Cho phương trình hóa học
2SO2(k) + O2(k) 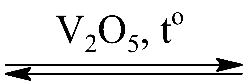 2SO3(k)
2SO3(k)
Cân bằng hóa học của phản ứng sẽ chuyển dịch về phía nào khi giảm nồng độ khí SO2?
- A. Chiều thuận
- B. Không dịch chuyển
- C. Cả chiều thuận và nghịch
- D. Chiều nghịch
Câu 3. Cho các cân bằng sau
(I) 2HI(k) ⇄ H2(k) + I2(k)
(II) CaCO3(r) ⇄ CaO(r) + CO2(k)
(III) FeO (r) + CO ⇄ Fe(r) + CO2(k)
(IV) 2SO2(k) + O2(k) ⇄ 2SO3
Khi giảm áp suất của hệ, cân bằng nào bị chuyển dịch theo chiều nghịch?
- A. II
- B. IV
- C. I
- D. III
Câu 4. Xét các hệ cân bằng trong bình kín
(1) C(r) + H2O(k) ⇄ CO(k) + H2 ∆ H > 0
(2) CO(k) + H2O(k) ⇄ CO2(k) + H2 ∆ H < 0
Các cân bằng trên chuyển dịch như thế nào khi tăng áp suất chung bằng cách nén cho thể ích của hệ giảm xuống?
- A. (1) chiều thuận; (2) chiều thuận
- B. (1) chiều nghịch; (2) chiều thuận
- C. (1) chiều nghịch; (2) chiều nghịch
- D. (1) chiều nghịch; (2) không đổi
II. Phần tự luận (6 điểm)
Câu 1(4 điểm): a) Nêu ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng hóa học?
b) Cho phản ứng:
2NO2(g) ⇌ N2O4(g)
Em hãy hoàn thành bảng dưới đây
Tác động | Chiều chuyển dịch cân bằng (thuận/nghịch | Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) |
Tăng nhiệt độ | ||
Giảm nhiệt độ |
Câu 2 (2 điểm): rộn 1,0 mol; 1,4 mol B và 0,5 mol C vào bình dung tích 1,0 lít. Phản ứng xảy ra: A + B ⇆ 2C. Khi cân bằng nồng độ của C là 0,75 M. Tính hằng số cân bằng KC của phản ứng.
Trắc nghiệm: (Mỗi câu đúng tương ứng với 1 điểm)
Câu hỏi | Câu 1 | Câu 2 | Câu 3 | Câu 4 |
Đáp án | B | D | B | D |
Tự luận:
Câu 1 (4 điểm)
a) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt (∆rH298o>0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại
b)
Xét phản ứng: 2NO2(g) ⇌ N2O4(g)
Tác động | Chiều chuyển dịch cân bằng (thuận/nghịch | Chiều chuyển dịch cân bằng (tỏa nhiệt/thu nhiệt) |
Tăng nhiệt độ | Theo chiều nghịch | Theo chiều thu nhiệt |
Giảm nhiệt độ | Theo chiều thuận | Theo chiều tỏa nhiệt |
Câu 2 (2 điểm)

Giải những bài tập khác
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận