Đề số 5: Đề kiểm tra KHTN 8 Cánh diều bài 3 Định luật bảo toàn khối lượng. Phương trình hoá học
III. DẠNG 3 – ĐỀ TRẮC NGHIỆM VÀ TỰ LUẬN
ĐỀ 5
I. Phần trắc nghiệm (4 điểm)
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Xét phương trình hóa học 2H2 + O2 → 2H2O. Tỷ lệ số phân tử các chất trong phản ứng là
A. 2:2:1
B. 2:1:2
C. 1:2:2
D. 1:1:2
Câu 2: Hình dưới mô tả thí nghiệm phản ứng của BaCl2 và Na2SO4. Trong cốc 1 đựng BaCl2 và cốc 2 đựng Na2SO4, lúc này cân ở trạng thái cân bằng.
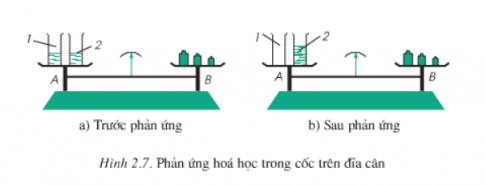
Tiếp theo ta tiến hành đổ cốc 1 vào cốc 2 thì thấy có hiện tượng xuất hiện kết tủa. Sơ đồ phản ứng: BaCl2 + Na2SO4 → NaCl + BaSO4 ↓. Sau khi phản ứng kết thúc, kim đồng hồ lệch về hướng nào?
- A. Kim sẽ lệch về phía quả cân
B. Kim sẽ lệch về phía cốc 1 và cốc 2
C. Kim sẽ nằm cân bằng ở giữa không lệch về bên nào
D. Không thể xác định được.
Câu 3: Cho 5,6 gam Fe phản ứng với 10,8 gam dung dịch HCl thu được 11,2 gam FeCl2 và b gam khí hidro. Giá trị của b là
A. 5,2 gam
B. 5,0 gam
C. 4,5 gam
D. 4,2 gam
Câu 4: Đốt cháy 1,2 gam carbon cần a gam oxygen, thu được 4,4 gam khí carbondioxide. Tính a.
A. 3,8 gam
B. 2,2 gam
C. 3,2 gam
D. 4,2 gam
II. Phần tự luận (6 điểm)
Câu 1(4 điểm): Tính khối lượng của FeS tạo thành trong phản ứng của Fe và S, biết khối lượng của Fe và S đã tham gia phản ứng lần lượt là 7 gam và 4 gam.
Câu 2 (2 điểm): Khi cho Mg tác dụng với chlohyđric acid thì khối lượng của mangessium chloride (MgCl2) nhỏ hơn tổng khối lượng của Mg và chlohyđric acid tham gia phản ứng. Điều này có phù hợp với định luật bảo toàn khối lượng không?
Trắc nghiệm: (Mỗi câu đúng tương ứng với 1 điểm)
Câu hỏi | Câu 1 | Câu 2 | Câu 3 | Câu 4 |
Đáp án | B | C | A | C |
Tự luận:
Câu 1:
Khối lượng của FeS tạo thành trong phản ứng là 7 + 4 = 11 gam.
Câu 2:
Khi cho Mg phản ứng với dung dịch HCl thấy khối lượng MgCl2 nhỏ hơn tổng khối lượng của Mg và HCl. Điều này đúng với định luật bảo toàn khối lượng vì có khối lượng hydrogen thoát ra ngoài dung dịch:
$m_{Mg}+m_{HCl}> m_{MgCl_2}$
Vì $m_{Mg}+m_{HCl}= m_{MgCl_2}+m_{H_2}$

Bình luận