Đề số 1: Đề kiểm tra hóa học 11 Kết nối bài 2 Cân bằng trong dung dịch nước
I. DẠNG 1 – ĐỀ KIỂM TRA TRẮC NGHIỆM
ĐỀ SỐ 1
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Chất nào sau đây không dẫn điện được?
- A. KCl rắn khan
- B. MgCl2 nóng chảy
- C. KOH nóng chảy
- D. HI trong dung môi nước
Câu 2: Dãy các chất đều là chất điện li mạnh là
- A. KOH, NaCl, H2CO3
- B. Na2S, Mg(OH)2, HCl
- C. HclO, NaNO3, Ca(OH)3
- D. HCl, Fe(NO3)3, Ba(OH)2
Câu 3: Theo thuyết Br∅nsted – Lowry chất nào dưới đây là acid?
- A. Cr(NO3)3
- B. CdSO4
- C. HbrO3
- D. CsOH
Câu 4: Đối với acid mạnh HNO3 0,10M nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
- A. [H+] > [NO3-]
- B. [H+] < [NO3-]
- C. [H+] < 0,10M
- D. [H+] = 0,10M
Câu 5: Dung dịch H2SO4 0,10M có
- A. pH = 1
- B. pH < 1
- C. pH > 1
- D. [H+] > 2,0M
Câu 6: Trộn 200 ml dung dịch H2SO4 0,05M với 300ml dung dịch HCl 0,1M thu được dung dịch Y. pH của dung dịch Y là
- A. 1
- B. 1,3
- C. 4
- D. 3
Câu 7: Dung dịch chất A làm quỳ tím ngả màu xanh, còn dung dịch chất B không làm đổi màu quỳ tím. Trộn lẫn dung dịch của hai chất lại thì xuất hiện kết tủa. A và B có thể là
- A. NaOH và K2SO4
- B. K2CO3 và Ba(NO3)2
- C. KOH và FeCl3
- D. Na2CO3 và KNO3
Câu 8: Cho các chất CH3COONa, NH4Cl, NaCl, Na2S, Na2SO3, KCl, Cu(NO3)2, FeCl3, K2SO4. Có bao nhiêu chất khi tan trong nước tạo dung dịch có môi trường acid?
- A. 4
- B. 5
- C. 3
- D. 2
Câu 9: Trộn 150 ml dung dịch HCl 1M với 100 ml dung dịch gồm Ba(OH)2 0,4M và NaOH 0,6M. Nhúng giấy quỳ tím vào dung dịch sau phản ứng có hiện tượng
- A. quỳ tím chuyển sang màu đỏ
- B. quỳ tím chuyển sang màu xanh
- C. quỳ tím không đổi màu
- D. không xác định được màu quỳ tím
Câu 10: Để xác định nồng độ dung dịch NaOH người ta tiến hành như sau
+ Cân 1,26 gam oxalic acid ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 ml.
+ Lấy 10 ml dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) thì hết 17,5 ml dung dịch NaOH. Tính nồng độ dung dịch NaOH đã dùng?
- A. 0,16M
- B. 0,124M
- C . 0,26M
- D. 0,114M
(Mỗi câu đúng tương ứng với 1 điểm)
Câu hỏi | Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 |
Đáp án | A | D | C | D | B |
Câu hỏi | Câu 6 | Câu 7 | Câu 8 | Câu 9 | Câu 10 |
Đáp án | A | B | C | A | D |
GIẢI CHI TIẾT
Câu 10 :
nH2C2O4.2H2O=1,2690+18,2=0,01 (mol)
100 ml dung dịch axit oxalic chứa 0,01 mol (COOH)2
10 ml ⟶ 0,001 mol
Đặt nNaOH = x mol.
Phenolphtalein xuất hiện màu hồng ở pH = 9 > 7
⟹ NaOH dư, (COOH)2 hết
PTHH: (COOH)2 + 2NaOH ⟶ (COONa)2 + 2H2O
Ban đầu: 0,001 x (mol)
Phản ứng: 0,001 ⟶ 0,002 (mol)
Sau: 0 x-0,002 (mol)
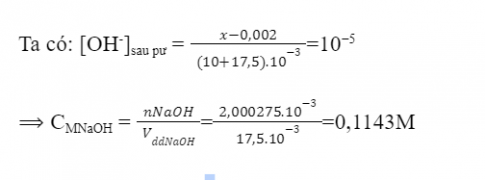
pH = 9 ⟹ pOH = 14 - 9 = 5 ⟹ [OH-]sau pư = 10-5
Giải những bài tập khác
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận