Giải bài 3 Sự điện li của nước. pH. Chất chỉ thị axit bazơ
Tech12h xin được chia sẻ với các bạn bài sự điện li của nước, pH, Chất chỉ thị axit - bazơ trong chương trình lớp 11. Hi vọng bài đăng này của chúng tôi sẽ giúp các bạn biết đánh giá độ axit , bazơ của dung dịch dựa vào độ pH và biết màu của một số chất chỉ thị trong dung dịch ở các khoảng pH khác nhau.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
A - Kiến thức trọng tâm
I. Nước là chất điện li yếu
1. Sự điện li của nước
- Nước điện li rất yếu theo phương trình sau:
![]()
2. Tích số ion của nước
- Vậy môi trường trung tính là môi trường có:
[H+] = [OH-]
- Tại 250C, trong nước nguyên chất có:
[H+] = [OH-] = 1,0.10-17 M.
- Đặt: KH2O = [H+] . [OH-] = 1,0.10-17 . 1,0.10-17 = 1,0.10-14
- KH2O được gọi tích số ion của nước.
- Ở nhiệt độ xác định, tích số này là hằng số không những trong nước tinh khiết mà cả trong những dung dịch loãng khác nữa.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
- Khi cho axit HCl vào nước, nồng độ H+ tăng, mà tích số ion trong nước không đổi nên nồng độ OH- phải giảm.
Ví dụ: Hòa tan HCl vào nước để được [H+] = 1,0.10-3M =>[OH-] = 1,0.10-11M
- Vậy môi trường axit là môi trường có:
[H+] > [OH-] hay [H+] > 1,0.10-7M
b. Môi trường kiềm
- Khi cho NaOH vào nước, nồng độ OH- tăng, mà tích số ion trong nước không đổi nên nồng độ H+ phải giảm.
- Vậy môi trường kiềm là môi trường có:
[H+] < [OH-] hay [H+] < 1,0.10-7M
Kết luận:
- Môi trường trung tính: [H+] > 1,0.10-7M
- Môi trường axit: [H+] < 1,0.10-7M
- Môi trường kiềm: [H+] → 1,0.10-7M
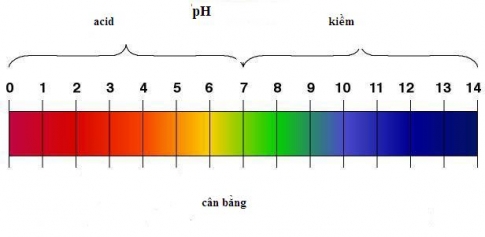
II. Khái niệm pH, chất chỉ thị axit – bazơ
1. Khái niệm về pH
- Để đánh giá độ kiềm, độ axit của dung dịch có thể dựa vào [H+].
- Để tránh ghi giá trị [H+] với số mũ âm, người ta dùng gía trị pH với quy ước:
pH = - lg[H+] ; [H+] = 10- pH
- Ta có
- pH = 7 môi trường trung tính.
- pH < 7 môi trường axit.
- pH > 7 môi trường kiềm.
- Thang pH thường dùng có giá trị từ 1 đến 14.
2. Chất chỉ thị axit – bazơ
- Chất chỉ thị axit – bazơ là chất có màu biến đổi phụ thuộc theo giá trị pH của dung dịch.
- Khi trộn lẫn một số chất chỉ thị axit – bazơ có màu biến đổi kế tiếp nhau theo giá trị pH ta thu được chất chỉ thị vạn năng.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận