Đề cương ôn tập Hóa học 10 chân trời sáng tạo học kì 2 (P2)
Đề cương ôn tập môn Hóa học lớp 10 bộ sách Chân trời sáng tạo mới là tài liệu giúp các em ôn tập củng cố lại toàn bộ kiến thức được của môn Hóa học 10. Tài liệu bao gồm các kiến thức trọng tâm, giúp các bạn ôn tập lại lý thuyết và luyện tập các dạng bài khác nhau để chuẩn bị tốt cho kì thi cuối kì 2 sắp tới. Sau đây mời các em tham khảo đề cương chi tiết
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ: TỐC ĐỘ PHẢN ỨNG HÓA HỌC VÀ NGUYÊN TỐ NHÓM VIIA - HALOGEN
1. Tốc độ phản ứng hóa học
- Tốc độ phản ứng của phản ứng hoá học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian)
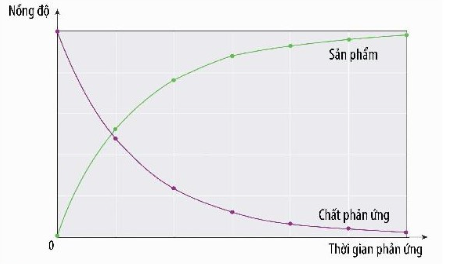
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
aA + bB → bC + dD
- Biểu thức tốc độ trung bình của phản ứng:
Trong đó:
: tốc độ trung bình của phản ứng
: sự biến thiên nồng độ
: biến thiên thời gian
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2
- Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hoá học được biểu diễn bằng biểu thức:
Trong đó:
+ k là hằng số tốc độ phản ứng
+ CA, CB là nồng độ (M) chất A, B tại thời điểm đang xét.
+ Khi nồng độ chất phản ứng bằng đơn vị (1 M) thì k = v, vậy k là tốc độ của phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng.
+ Hằng số k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ.
- Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Ảnh hưởng của nồng độ: Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
+ Ảnh hưởng của nhiệt độ: Khi tăng nhiệt độ, tốc độ phản ứng tăng.
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hoá học được biểu diễn bằng công thức:
Trong đó: vt1, vt2 là tốc độ phản ứng ở 2 nhiệt độ t1 và t2; là hệ số nhiệt độ Van't Hoff.
Quy tắc Vant Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
+ Ảnh hưởng của áp suất: Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
+ Ảnh hưởng của bề mặt tiếp xúc: Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
+ Ảnh hưởng của chất xúc tác: Chất xúc tác làm tăng tốc độ của phản ứng hoá học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
2. Nguyên tố nhóm VIIA - Halogen
- Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts).
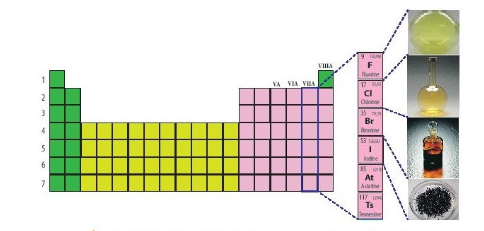
- Cấu hình electron, đặc điểm cấu tạo phân tử halogen
+ Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2np5)
+ Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực. 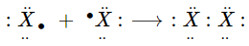
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
- Tính chất vật lý:
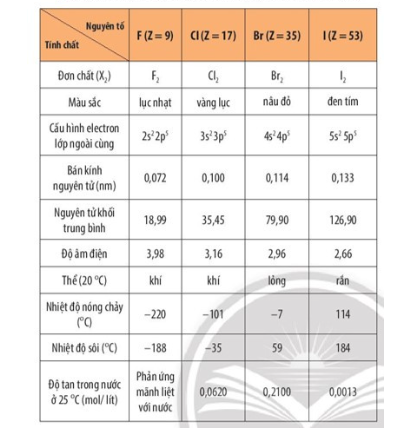
- Tính chất hóa học:
+ Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng.
Sơ đồ tổng quát: X + 1e → X-
+ Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
+ Tác dụng với kim loại
+ Tác dụng với hydrogen
+ Tác dụng với dung dịch muối halide
+ Tác dụng với dung dịch kiềm
- Hydrogen Halide và một số phản ứng của ion Halide
+ Tính chất vật lí của Hydrogen Halide
Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng.
Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
+ Hydrohalic Acid: Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
+ Tính khử của các ion Halide: Tính khử của các ion halide tăng theo chiều F- < Cl- < Br- < I-
+ Nhận biết ion Halide trong dung dịch: Phân biệt các ion F-, Cl-, Br- và I- bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng.

Bình luận