Dễ hiểu giải Hóa học 11 Chân trời bài 19 Carboxyluc acid
Giải dễ hiểu bài 19 Carboxyluc acid. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 11 Chân trời dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 19: CARBOXYLIC ACID
KHỞI ĐỘNG
Một số loại acid hữu cơ được dùng trong, thực phẩm như acetic acid, lactic acid. Thường gặp nhất là carboxylic acid, có nhiều trong tự nhiên như trong thành phần của các loại trái cây, chúng gây ra vị chua và một số mùi quen thuộc. Carboxylic acid là gi? Những tính chất nào đặc trưng cho carboxylic acid?
Giải nhanh:
- Là những hợp chất hữu cơ mà phân tử có nhóm carboxyl liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydro.
- Tính acid, phản ứng ester hoá là các tính chất đặc trưng.
1. KHÁI NIỆM - CẤU TRÚC - DANH PHÁP
Thảo luận 1: Quan sát hình 19.1, hãy nêu đặc điểm chung về cấu tạo của carboxylic acid, nêu đặc điểm khác về cấu tạo của carboxylic acid so với cấu tạo của aldehyde và ketone.
Giải nhanh:
- Nó có chứa một hay nhiều nhóm carboxyl –COOH liên kết với carbon hoặc hydrogen trong phân tử.
- Aldehyde, ketone chỉ có nhóm carbonul C=O, carboxylic acid có nhóm carbonyl liên kết trực tiếp với nhóm hydroxy.
Luyện tập 1: Hãy viết công thức cấu tạo của các carboxylic acid đơn chức có công thức phân tử C4H8O2
Giải nhanh:
CH3-CH2-CH2-COOH
CH3-CH(CH3)-COOH
Luyện tập 2: Hãy chỉ ra hợp chất carboxylic acid trong số các chất sau đây:
CH3CHO (1), C6H5OH (2), CH2 = CH - COOH (3), HOOC - COOH (4).
Giải nhanh:
Là chất (3), (4).
Thảo luận 2: Dựa vào bảng 19.1, rút ra cách gọi tên carboxylic acid theo danh pháp thay thế.
Giải nhanh:
Số chỉ vị trí mạch nhánh - Tên nhánh + Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
Luyện tập 1: Gọi tên theo danh pháp thay thế của các carboxylic acid sau:
a) (CH3)2CH-COOH b) (CH3)3C-COOH
c) CH3CH=CH-COOH d) CH3CH=C(CH3)-COOH
Giải nhanh:
a) 2-methylpropanoic acid
b) 2,2-dimethylpropanoic acid
c) but-2-enoic acid
d) 2-methylbut-2-enoic acid.
Luyện tập 2: Viết công thức cấu tạo của các carboxylic acid có tên sau:
a) propanoic acid b) pen-3-enoic acid
Giải nhanh:
a) CH3CH2COOH
b) CH3CH=CH-CH2-COOH
Luyện tập 3: Viết công thức cấu tạo các đồng phân acid có công thức phân tử C5H10O2. Gọi tên theo danh pháp thay thế của các đồng phân đó.
Giải nhanh:
CH3CH2CH2CH2COOH: pentanoic acid
(CH3)2CHCH2COOH: 2-methylbutanoic acid
CH3CH2CH(CH3)COOH: 3-methylbutanoic acid
(CH3)3C-COOH: 2,2-dimethylpropanoic acid
2. TÍNH CHẤT VẬT LÍ
Thảo luận 3: So sánh nhiệt độ sôi của butanoic acid với nhiệt độ sôi của các chất trong bảng sau. Giải thích.
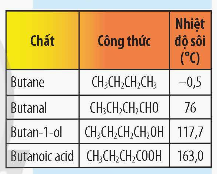
Giải nhanh:
Nhiệt độ sôi của butanoic acid lớn nhất. Do butanoic acid có khả năng liên kết hydrogen bền vững.
Thảo luận 4: Vì sao acetic acid tan vô hạn trong nước?
Giải nhanh:
Vì nó có khả năng tạo liên kết hydrogen với nước.
Luyện tập: Hãy sắp xếp theo chiều tăng dần nhiệt độ sôi của các chất sau, giải thích.
(1) C3H8 (2) C2H5COOH
(3) C2H5CHO (4) C3H7OH
Giải nhanh:
Thứ tự đúng là: (1) < (3) < (4) < (2)
Vì aldehyde không có liên kết hydrogen nên nhiệt độ sôi thấp hơn alcohol nhưng cao hơn alkane. Alcohol có nhiệt sộ sôi cao hơn aldehyde vì có liên kết hydrogen và carboxylic acid có nhiệt độ sôi cao nhất vì có liên kết hydrogen giữa 2 phân tử hoặc giữa nhiều phân tử.
3. TÍNH CHẤT HOÁ HỌC
Thảo luận 5: Từ đặc điểm cấu tạo nhóm carboxyl, dự đoán tính chất hóa học đặc trưng của hợp chất carboxylic acid
Giải nhanh:
Tính chất đặc trưng là tính acid.
Thảo luận 6: Biết Ka (hằng số phân li) acid của R - COOH được tính theo biểu thức sau:
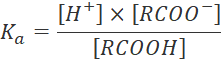
Dựa vào Bảng 19.3 nhận xét về tính acid của carboxylic acid. Nêu tính chất hóa học đặc trưng của chúng.
Giải nhanh:
- Carboxylic acid là acid yếu
- TCHH đặc trưng là tính acid yếu.
Thảo luận 7: Tiến hành thí nghiệm 1 theo hướng dẫn. Nêu hiện tượng xảy ra. Giải thích và viết phương trình hóa học của phản ứng
Giải nhanh:
- Quỳ tím chuyển đỏ vì acetic acid có tính acid yếu.
- Kim loại magnesium tan dần và có khí không màu thoát ra.
PTHH: 2CH3COOH + Mg → (CH3COO)2Mg + H2
- Tạo dung dịch không màu và có khí thoát ra.
PTHH: 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
Vận dụng: Hãy lựa chọn hóa chất hợp lí để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng. Giải thích.
Giải nhanh:
Dùng giấm hay nước chanh vắt có chứa các acid hữu cơ. Vì nó có khả năng hoà tan CaCO3 hoặc MgCO3.
PTHH: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
2CH3COOH + MgCO3 → (CH3COO)2Mg+ CO2 + H2O
Luyện tập 1: Hoàn thành các phương trình hóa học của các phản ứng sau
a) (CH3)2CHCOOH + Ca →
b) HOOC - COOH + NaOH →
c) HCOOH + Na2CO3 →
d) C2H5COOH + CuO →
Giải nhanh:
a) 2(CH3)2CHCOOH + Ca → ((CH3)2CHCOO)2Ca + H2
b) HOOC - COOH + 2NaOH → NaOOC - COONa + 2H2O
c) 2HCOOH + Na2CO3 → 2HCOONa + CO2 + H2O
d) 2C2H5COOH + CuO → (C2H5COO)2Cu + H2O
Luyện tập 2: Trình bày cách phân biệt các dung dịch sau bằng phương pháp hóa học: ethanol, acetaldehyde, acetic acid và acrylic acid
Giải nhanh:
| C2H5OH | CH3CHO | CH3COOH | CH2=CHCOOH |
Quỳ tím | - | - | Hoá đỏ | Hoá đỏ |
Nhóm mẫu 1 | Nhóm mẫu 2 | |||
Dung dịch AgNO3/NH3 dư | - | Tạo Ag kết tủa |
|
|
Nước bromine |
|
| - | Mất màu Br2 |
PTHH: CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH
CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 2Ag + 3NH3 + H2O
Thảo luận 8: Tiến hành thí nghiệm 2 theo các bước. Quan sát, nêu hiện tượng. Dấu hiệu nào giúp nhận biết có sản phẩm mới được tạo thành? Giải thích
Giải nhanh:
- Có hơi thoát ra và ngưng tụ trong ống nghiệm thu, sản phẩm là chất lỏng sánh, không tan trong nước và có mùi đặc trưng. Do phản ứng giữa acetic acid và ethanol tạo ester ethyl acetate.
- Dấu hiệu: sản phẩm có mùi thơm, không tan trong nước, nổi trên mặt nước.
PTHH: CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Thảo luận 9: Nêu vai trò của dung dịch H2SO4 đặc, đá bột, dung dịch NaCl bão hòa.
Giải nhanh:
- H₂SO₄ đặc: chất xúc tác, chất hút nước, phản ứng xảy ra nhanh hơn.
- NaCl bão hoà: ethyl acetate tách lớp nổi lên trên tốt hơn.
- Đá bọt: phản ứng sôi đều, không bị sôi mạnh cục bộ.
Thảo luận 10: Nêu một số biện pháp để nâng cao hiệu suất của phản ứng
Giải nhanh:
- Tăng nồng độ chất tham gia bằng cách lấy dư.
- Chưng cất, tách lấy sản phẩm.
Luyện tập: Viết phản ứng tạo thành ester có công thức CH3COOCH3 từ acid và alcohol tương ứng. Tìm hiểu ứng dụng của ester trong thực tiễn.
Giải nhanh:
PTHH: CH3COOH + CH3OH ⇌ H2O + CH3COOCH3
Ứng dụng: làm dung môi hoà tan keo, sơn và tẩy sơn móng tay.
4. ỨNG DỤNG CỦA MỘT SỐ CARBOXYLIC ACID THÔNG DỤNG
Thảo luận 11: Quan sát hình 19.5, nêu một số ứng dụng của carboxylic acid
Giải nhanh:
- Tổng hợp hữu cơ, polymer
- Sản xuất xà phòng
- Sản xuất mĩ phẩm, dược phẩm, phẩm nhuộm,
- Bảo quản thực phẩm
- Công nghệ dệt,...
5. ĐIỀU CHẾ
Thảo luận 12: Phương pháp điều chế acetic acid bằng cách lên men giấm cần thực hiện trong những điều kiện nào? Giải thích. Nêu ứng dụng trong thực tiễn của phương pháp trên.
Giải nhanh:
Phương pháp điều chế acetic acid bằng cách lên men giấm cần thực hiện trong những điều kiện nào
- Vật dụng đựng giấm phải được tiệt trùng trước: Vì giấm có tính acid nên rất dễ trở thành dung môi hòa tan các chất độc hại trong vật liệu đựng. Các loại sành có chất liệu chính là đất nung nên có khả năng chứa các kim loại nặng, nếu dùng để đựng giấm dễ có nguy cơ thôi nhiễm, không tốt cho sức khỏe.
- Trước khi đậy nắp hũ để ủ giấm, sử dụng một tấm vải mỏng phủ lên miệng hũ, vì men giấm cần không khí để có thể phát triển nên bít một tấm vải lên như vậy vừa đảm bảo tránh được côn trùng và bụi bẩn, vừa có thể để không khí lọt vào hũ.
- Nhiệt độ thích hợp giúp mem giấm phát triển tốt là 20oC - 30oC
Ứng dụng thực tiễn của phương pháp lên men giấm, có thể sử dụng làm thực phẩm và còn được sử dụng nhiều trong làm đẹp, đời sống va y tế như: khắc phục bong gân, máu bầm; Kiểm soát lượng đường trong máu; Hỗ trợ hấp thu các chất dinh dưỡng khác; giúp ngủ ngon; chống lão hóa da; giảm nám bằng giấm; lưu giữ mùi vị và màu sắc món ăn; tác dụng kháng khuẩn;...
- Điều kiện: C2H5OH cần sử dụng ở nồng độ loãng vừa phải, quá trình lên men ở điều kiện nhiệt độ thường 20 oC – 30 oC và cần để thoáng khí.
- Ứng dụng: điều chế giấm ăn.
Vận dụng: Tìm hiểu phương pháp lên men giấm và thực hành làm giấm ăn từ các nguyên liệu có sẵn để sử dụng trong gia đình.
Giải nhanh:
Cách làm giấm táo
- Nguyên liệu: 3 kg táo, 1 lít giấm gạo, 1 bát đường phèn, hũ đựng giấm.
- Sơ chế: rửa sạch táo, ngâm muối để làm sạch táo; cắt táo thành từng miếng, thái mỏng và bỏ hạt; rửa sạch hũ rồi để khô.
- Cách làm:
+ Bước 1: Xếp 1 lớp táo xuống đáy hũ, sau đó đổ 1 lớp đường lên lớp táo. Rồi lại tiếp tục xếp 1 lớp táo đến 1 lớp đường cho đến hết. Kết thúc bằng ớp đường trên cùng.
+ Bước 2: Đổ giấm gạo vào hũ táo sao cho ngập táo
+ Bước 3: Đậy kín nắp, sau đó đặt ở nơi thoáng mát và ít ánh sáng khoảng 2 tháng.
+ Bước 4: Thỉnh thoảng kiểm tra giấm.
+ Bước 5: Sử dụng.
BÀI TẬP
Bài 1: Viết phương trình hóa học các phản ứng xảy ra theo sơ đồ sau, ghi rõ điều kiện phản ứng (nếu có)
CH2 = CH2 → CH3CH2OH → CH3COOC2H5
Giải nhanh:
PTHH: CH2 = CH2 + H2O → CH3CH2OH
CH3CH2OH + CH3COOH ⇌ CH3COOC2H5 + H2O
Bài 2: Xác định các chất X, Y, Z và hoàn thành các phản ứng sau
a) sodium hydroxide + X → sodium methanoate + nước
b) 3-methylbutanoic acid + Mg → Y + Z
Giải nhanh:
a) NaOH + HCOOH → HCOONa + H2O
X là HCOOH.
b)2(CH3)2CHCH2COOH + Mg → ((CH3)2CHCH2COO)Mg + H2
Y là ((CH3)2CHCH2COO)Mg, Z là H2.
Bài 3: Bằng kiến thức hoá học, em hãy giải thích các cách làm sau đây:
a) Khi đồ dùng có đốm gỉ, sử dụng giấm để lau chùi, vết gỉ sẽ hết.
b) Khi thực hiện lên men rượu cần ủ kín, còn khi lên men giấm cần để thoáng.
Giải nhanh:
a) Vì giấm có đầy đủ tính chất của acid nên có thể tẩy được
b) - Nếu không thì C2H5OH tác dụng với oxygen không khí.
- Do phản ứng lên men giấm cần cung cấp oxygen.
Bài 4: Điều chế ethyl acetate bằng cách cho 6 gam acetic acid tác dụng với 5,2 gam ethanol cứ xúc tác là dung dịch sulfuric acid đặc và đun nóng, thu được 5,28 gam ester. Tính hiệu suất của phản ứng.
Giải nhanh:
Ta có: nCH3COOH = 0,10mol
nC2H5OH ≈ 0,113mol => ethanol dư nên tính theo acetic acid
nCH3COOC2H5 (thực tế) = 0,06mol
PTHH: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
nester (lí thuyết) = 0,1 mol
H = ![]() = 60%
= 60%
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận