Dễ hiểu giải Hóa học 11 Chân trời bài 1 Khái niệm về cân bằng hóa học
Giải dễ hiểu bài 1 Khái niệm về cân bằng hóa học. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 11 Chân trời dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
KHỞI ĐỘNG
Trong các phản ứng hóa học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng tạo để tạo thành các chất đầu. Do vậy, phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao. Phản ứng tổng hợp amonia từ nitrogen và hydrogen thuộc loại phản ứng này. Các phản ứng này được gọi là phản ứng gì? Để tăng hiệu suất của chúng cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,... như thế nào?
Giải nhanh:
- Được gọi là phản ứng thuận nghịch.
- Cần vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier.
1. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HOÁ HỌC
Thảo luận 1: Dựa vào phương trình hóa học của phản ứng điều chế khí Oxyden từ KMnO4. Em hãy cho biết phản ứng có xảy ra theo chiều ngược lại hay không?
Giải nhanh:
Không xảy ra theo chiều ngược lại.
Luyện tập: Viết phương trình hóa học của một số phản ứng một chiều mà em biết.
Giải nhanh:
VD: NaOH + 2HCl → NaCl + H2O
Fe + H2SO4 → FeSO4 + H2
Thảo luận 2: Phản ứng Cl2 tác dụng với H2O có đặc điểm gì khác với phản ứng nhiệt phân thuốc tím?
Giải nhanh:
Phản ứng Cl2 tác dụng với H2O là phản ứng thuận nghịch còn phản ứng nhiệt phân thuốc tím là phản ứng 1 chiều.
Luyện tập: Trên thực tế có các phản ứng sau:
2 H2 + O2 → 2H2O (1)
2H2O  2H2 + O2 (2)
2H2 + O2 (2)
Vậy có thể viết: 2H2 + O2 ⇌ 2H2O được không? Vì sao?
Giải nhanh:
Không thể viết do hai phản ứng không cùng điều kiện phản ứng.
Thảo luận 3: Quan sát hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi)
Giải nhanh:
Nồng độ của N2, H2 giảm dần và NH3 tăng dần đến một thời điểm nồng độ các chất không đổi theo thời gian.
Thảo luận 4: Quan sát hình 1.2, nhận xét về tốc độ phản ứng thuận và tốc độ phản ứng theo thời gian trong điều kiện nhiệt độ không đổi.
Giải nhanh:
Ban đầu tốc độ phản ứng thuận tăng và phản ứng nghịch tăng dần. Đến thời điểm cân bằng thì chúng bằng nhau.
2. HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
Thảo luận 5: Sử dụng dữ liệu bảng 1.1, hãy tính giá trị của biểu thức 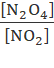 trong 5 thí nghiệm nhận xét giá trị thu được từ các thí nghiệm khác nhau
trong 5 thí nghiệm nhận xét giá trị thu được từ các thí nghiệm khác nhau
Bảng 1.1 Dữ liệu thực hiện về nồng độ các khí trước và sau khi hệ đạt trạng thái cân bằng ở 25oC
Thí nghiệm | Nồng độ ban đầu, mol/L | Nồng độ ở trạng thái cân bằng, mol/L | ||
CNO2 | CN2O4 | [NO2] | [N2O4] | |
1 | 0,0000 | 0,6700 | 0,0547 | 0,6430 |
2 | 0,0500 | 0,4460 | 0,0457 | 0,4480 |
3 | 0,0300 | 0,5000 | 0,0475 | 0,4910 |
4 | 0,0400 | 0,6000 | 0,0523 | 0,5940 |
5 | 0,2000 | 0,0000 | 0,0204 | 0,0898 |
Giải nhanh:
- Đặt x = 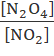
+ Thí nghiệm 1: x1 = 214,9.
+ Thí nghiệm 2: x2 = 214,51.
+ Thí nghiệm 3: x3 = 217,62.
+ Thí nghiệm 4: x4 = 217,16.
+ Thí nghiệm 5: x5 = 215,78.
- Nhận xét: các giá trị thu được gần bằng nhau.
Thảo luận 6: Viết các biểu thức tính tốc độ phản ứng thuận và tốc độ phản ứng nghịch của phản ứng thuận nghịch sau, biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản:
aA + bB ⇌ cC + dD
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Giải nhanh:
Biểu thức: 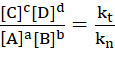
Luyện tập: Cho hệ cân bằng sau:
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
Viết biểu thức tính hằng số cân bằng KC của phản ứng trên.
Giải nhanh:
Biểu thức: 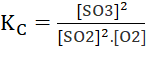
3. SỰ CHUYỂN DỊCH CÂN BẰNG HOÁ HỌC
Thảo luận 7: Nêu hiện tượng xảy ra trong thí nghiệm 1, từ đó cho biết chiều chuyển dịch cân bằng của phản ứng trong bình (2) và bình (3).
Giải nhanh:
- Hiện tượng: màu hỗn hợp khí trong bình (2) nhạt dần còn trong bình (3) đậm dần.
- Cân bằng chuyển dịch trong bình (2) theo chiều thuận còn trong bình (3) là theo chiều nghịch.
Thảo luận 8: Nhận xét hiện tượng xảy ra trong thí nghiệm 2
Giải nhanh:
Nhận xét: thấy màu hỗn hợp trong bình (1) đậm dần lên.
Thảo luận 9: Khi đun nóng phản ứng trong bình (1) chuyển dịch xảy ra theo chiều nào?
Giải nhanh:
Chuyển dịch theo chiều thuận.
4. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HOÁ HỌC
Thảo luận 10: Cho biết chiều nào của phản ứng (1) là chiều thu nhiệt và chiều nào là chiều tỏa nhiệt?
Giải nhanh:
Chiều thuận tỏa nhiệt, chiều nghịch thu nhiệt.
Thảo luận 11: Từ hiện tượng ở thí nghiệm 1, cho biết khi làm lạnh bình (2) và khi làm nóng bình (3) thì cân bằng trong mỗi bình chuyển dịch theo chiều toả nhiệt hay thu nhiệt.
Giải nhanh:
Ở bình (2) cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt còn bình (3) thì theo chiều phản ứng thu nhiệt.
Luyện tập: Người ta thường sản xuất vôi bằng phản ứng nhiệt phân calcium carbonate theo phương trình phản ứng hóa học sau
CaCO3 (s) ⇌ CaO(s) + CO2(s) ΔrH0298 = 178,49 kJ
Để nâng cao hiệu suất phản ứng ảnh sản xuất vôi cần điều chỉnh nhiệt độ như thế nào. Giải thích.
Giải nhanh:
Cần tăng nhiệt độ phản ứng vì khi đó cân bằng chuyển dịch theo chiều phản ứng theo chiều thuận.
Thảo luận 12: Khi đẩy hoặc kéo pit-tong thì số mol khí ở hệ (2) thay đổi như thế nào?
Giải nhanh:
- Khi đẩy pit-tong thì số mol khí của hệ giảm.
- Khi kéo pit tong ra thì số mol khí của hệ tăng.
Luyện tập: Phản ứng tổng hợp amonia
N2(g) + 3H2(g) ⇌ 2NH3(g)
Để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất như thế nào?
Giải nhanh:
Ta cần phải tăng áp suất.
Thảo luận 13: Hãy cho biết cân bằng chuyển dịch theo chiều nào khi thêm một lượng khí CO vào hệ cân bằng (3)
Giải nhanh:
Cân bằng chuyển dịch theo chiều nghịch.
Vận dụng: Trong các hang động đá vôi thường xảy ra hiện tượng hình thành thạch nhũ và xâm thực của nước mưa vào đá vôi theo phương trình hóa học sau
CaCO3 + H2O + CO2 ⇌ Ca(HCO3)2
Hãy giải thích các quá trình này.
Giải nhanh:
- Nước mưa có hoà tan CO2 bào mòn đá: CaCO3(s) + H2O(l) + CO2(aq) → Ca(HCO3)2(aq).
- Sau đó Ca(HCO3)2 chảy nhỏ giọt từ trần hang động, tại đó chúng bị phân huỷ dần tạo thành thạch nhũ: Ca(HCO3)2(aq) → CaCO3(s) + H2O(l) + CO2(aq).
BÀI TẬP
Bài 1: Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ. B. nhiệt độ C. Áp suất. D. Chất xúc tác.
Giải nhanh:
Chọn B.
Bài 2: Yếu tố nào sau đây luôn luôn không làm chuyển dịch cân bằng của hệ phản ứng?
A. Nồng độ. B. nhiệt độ C. Áp suất. D. Chất xúc tác.
Giải nhanh:
Chọn D.
Bài 3: Viết biểu thức tính KC cho các phản ứng sau:
(1) CaCO3(s) ⇌ CaO(s) + CO2(g)
(2) Cu2O(s) + ![]() (g) ⇌ 2CuO(g)
(g) ⇌ 2CuO(g)
Giải nhanh:
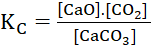
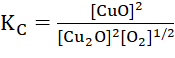
Bài 4: Xét các hệ cân bằng sau trong một bình kín:
a) C(s) + H2O(g) ⇌ CO(g) + H2(g) 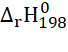 =131 kJ
=131 kJ
b) CO(g) + H2O(g) ⇌ CO2(g) + H2(g) 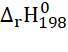 = -41 kJ
= -41 kJ
Các cân bằng trên chuyển dịch theo chiều nào khi thay đổi một trong các yếu tố sau
(1) Tăng nhiệt độ
(2) Thêm lượng hơi nước vào hệ
(3) Thêm khí H2 vào hệ
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống
(5) Dùng chất xúc tác
Giải nhanh:
Các yếu tố | Phản ứng a | Phản ứng b |
(1) | Thuận | Nghịch |
(2) | Thuận | Thuận |
(3) | Nghịch | Nghịch |
(4) | Nghịch | Không đổi |
(5) | Không đổi | Không đổi |
Bài 5: Cho phản ứng sau
COCl2 ⇌ Cl2 + CO Kc = 8,2.10 −2 ở 900K
Tại trạng thái cân bằng nếu nồng độ CO và Cl2 đều bằng 0,15 M thì nồng độ độ COCl2 là bao nhiêu?
Giải nhanh:
Nồng độ độ COCl2 là: KC = 0,274 M.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận