5 phút giải Hóa học 11 Chân trời sáng tạo trang 5
5 phút giải Hóa học 11 Chân trời sáng tạo trang 5. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
CHƯƠNG 1. CÂN BẰNG HÓA HỌC
BÀI 1: KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Trong các phản ứng hóa học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng tạo để tạo thành các chất đầu. Do vậy, phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao. Phản ứng tổng hợp Amonia từ Nitrogen và hydrogen thuộc loại phản ứng này. Các phản ứng này được gọi là phản ứng gì? Để tăng hiệu suất của chúng cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,... như thế nào?
1. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HOÁ HỌC
Bài 1: Dựa vào phương trình hóa học của phản ứng điều chế khí Oxyden từ KMnO4. Em hãy cho biết phản ứng có xảy ra theo chiều ngược lại hay không?
Bài 2: Viết phương trình hóa học của một số phản ứng một chiều mà em biết.
Bài 3: Phản ứng Cl2 tác dụng với H2O có đặc điểm gì khác với phản ứng nhiệt phân thuốc tím?
Bài 4: Trên thực tế có các phản ứng sau:
2 H2 + O2 → 2H2O (1)
2H2O →Dienphan 2H2 + O2 (2)
Vậy có thể viết: 2H2 + O2 ⇌ 2H2O được không? Vì sao?
Bài 5: Quan sát hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi)
Bài 6: Quan sát hình 1.2, nhận xét về tốc độ phản ứng thuận và tốc độ phản ứng theo thời gian trong điều kiện nhiệt độ không đổi.
2. HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
Bài 1: Sử dụng dữ liệu bảng 1.1, hãy tính giá trị của biểu thức [N2O4][NO2]2 trong 5 thí nghiệm nhận xét giá trị thu được từ các thí nghiệm khác nhau
Bảng 1.1 Dữ liệu thực hiện về nồng độ các khí trước và sau khi hệ đạt trạng thái cân bằng ở 25oC
Thí nghiệm | Nồng độ ban đầu, mol/L | Nồng độ ở trạng thái cân bằng, mol/L | |||||||
CNO2 | CN2O4 | [NO2] | [N2O4] | ||||||
1 | 0,0000 | 0,6700 | 0,0547 | 0,6430 | |||||
2 | 0,0500 | 0,4460 | 0,0457 | 0,4480 | |||||
3 | 0,0300 | 0,5000 | 0,0475 | 0,4910 | |||||
4 | 0,0400 | 0,6000 | 0,0523 | 0,5940 | |||||
5 | 0,2000 | 0,0000 | 0,0204 | 0,0898 | |||||
5 | 0,2000 | 0,0000 | 0,0204 | 0,0898 | 215,7824 | ||||
Bài 2: Viết các biểu thức tính tốc độ phản ứng thuận và tốc độ phản ứng nghịch của phản ứng thuận nghịch sau, biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản
aA + bB ⇌ cC + dD
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Bài 3: Cho hệ cân bằng sau:
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
Viết biểu thức tính hằng số cân bằng KC của phản ứng trên.
3. SỰ CHUYỂN DỊCH CÂN BẰNG HOÁ HỌC
Bài 1: Nêu hiện tượng xảy ra trong thí nghiệm 1, từ đó cho biết chiều chuyển dịch cân bằng của phản ứng trong bình (2) và bình (3).
Bài 2: Nhận xét hiện tượng xảy ra trong thí nghiệm 2
Bài 3: Khi đun nóng phản ứng trong bình (1) chuyển dịch xảy ra theo chiều nào?
4. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HOÁ HỌC
Bài 1: Cho biết chiều nào của phản ứng (1) là chiều thu nhiệt và chiều nào là chiều tỏa nhiệt?
Bài 2: Từ hiện tượng ở thí nghiệm 1, cho biết khi làm lạnh bình (2) và khi làm nóng bình (3) thì cân bằng trong mỗi bình chuyển dịch theo chiều toả nhiệt hay thu nhiệt.
Bài 3: Người ta thường sản xuất vôi bằng phản ứng nhiệt phân Calcium carbonate theo phương trình phản ứng hóa học sau
CaCO3 (s) ⇌ CaO(s) + CO2(s) ΔrH0298 = 178,49 kJ
Để nâng cao hiệu suất phản ứng ảnh sản xuất vôi cần điều chỉnh nhiệt độ như thế nào. Giải thích.
Bài 4: Khi đẩy hoặc kéo pit-tong thì số mol khí ở hệ (2) thay đổi như thế nào?
Bài 5: Phản ứng tổng hợp Amonia
N2(g) + 3H2(g) ⇌ 2NH3(g)
Để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất như thế nào?
Bài 6: Hãy cho biết cân bằng chuyển dịch theo chiều nào khi thêm một lượng khí CO vào hệ cân bằng (3)
Bài 7: Trong các hang động đá vôi thường xảy ra hiện tượng hình thành thạch nhũ và xâm thực của nước mưa vào đá vôi theo phương trình hóa học sau
CaCO3 + H2O + CO2 ⇌ Ca(HCO3)2
Hãy giải thích các quá trình này.
BÀI TẬP
Bài 1: Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ. B. nhiệt độ C. Áp suất. D. Chất xúc tác.
Bài 2: Yếu tố nào sau đây luôn luôn không làm chuyển dịch cân bằng của hệ phản ứng?
A. Nồng độ. B. nhiệt độ C. Áp suất. D. Chất xúc tác.
Bài 3: Viết biểu thức tính KC cho các phản ứng sau...
Bài 4: Xét các hệ cân bằng sau trong một bình kín...
Các cân bằng trên chuyển dịch theo chiều nào khi thay đổi một trong các yếu tố sau
(1) Tăng nhiệt độ
(2) Thêm lượng hơi nước vào hệ
(3) Thêm khí H2 vào hệ
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống
(5) Dùng chất xúc tác
Bài 5: Cho phản ứng sau
COCl2 ⇌ Cl2 + CO Kc = 8,2 .10 −2 ở 900k
Tại trạng thái cân bằng nếu nồng độ CO và Cl2 đều bằng 0,15 M thì nồng độ độ COCl2 là bao nhiêu?
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
Phản ứng thuận nghịch.
Dùng nguyên lí chuyển dịch cân bằng Le Chatelier để chuyển dịch cân bằng theo mong muốn để tăng hiệu suất phản ứng.
1. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HOÁ HỌC
Bài 1:
Phản ứng không xảy ra theo chiều ngược lại
Bài 2:
NaOH + 2HCl → NaCl + H2O
Fe + H2SO4 → FeSO4 + H2
Bài 3:
Sản phẩm sinh ra có khả năng phản ứng tạo để tạo thành các chất đầu.
Bài 4:
Không thể viết: vì không cùng điều kiện phản ứng
Bài 5:
Nồng độ của các chất N2, H2 giảm dần và NH3 tăng dần đến một thời điểm nồng độ các chất không đổi theo thời gian.
Bài 6:
Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
2. HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
Bài 1:
Thí nghiệm | Nồng độ ban đầu, mol/L | Nồng độ ở trạng thái cân bằng, mol/L | [N2O4][NO2]2 | ||
CNO2 | CN2O4 | [NO2] | [N2O4] | ||
1 | 0,0000 | 0,6700 | 0,0547 | 0,6430 | 214,9000 |
2 | 0,0500 | 0,4460 | 0,0457 | 0,4480 | 214,5090 |
3 | 0,0300 | 0,5000 | 0,0475 | 0,4910 | 217,6177 |
4 | 0,0400 | 0,6000 | 0,0523 | 0,5940 | 217,1616 |
5 | 0,2000 | 0,0000 | 0,0204 | 0,0898 | 215,7824 |
Nhận xét: Giá trị [N2O4][NO2]2 thu được có giá trị gần bằng nhau (xấp xỉ)
Bài 2:
Cân bằng vt= vn ⇔ kt[A]a[B]b = kn[C]c[D]d
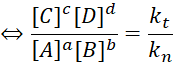
Bài 3:

3. SỰ CHUYỂN DỊCH CÂN BẰNG HOÁ HỌC
Bài 1:
(2) Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thuận
(3) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng nghịch
Bài 2:
Hiện tượng: bình 1 phenolphthalein chuyển màu hồng --> phản ứng xảy ra theo chiều thuận
Bài 3:
Chiều thuận
4. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HOÁ HỌC
Bài 1:
Chiều thuận toả nhiệt, chiều nghịch thu nhiệt.
Bài 2:
Bình (2): tỏa nhiệt
Bình (3): thu nhiệt
Bài 3:
Cần tăng nhiệt độ phản ứng.
Vì phản ứng sẽ xảy ra theo chiều thuận --> nâng cao hiệu suất.
Bài 4:
Khi đẩy pit-tong ---> số mol khí của hệ giảm
Khi kéo pit tong ra ---> số mol khí của hệ tăng
Bài 5
Tăng áp suất.
Bài 6:
Theo chiều nghịch
Bài 7:
Phản ứng xảy ra theo chiều thuận giải thích sự xâm thực đá vôi của nước mưa do nước mưa khí quyển có chứa CO2 sẽ hòa tan mạnh đá vôi, chuyển thành Ca(HCO3)2.
Phản ứng xảy ra theo chiều nghịch giải thích sự tạo thành thạch nhũ do khi Ca(HCO3)2 hòa tan trong nước đi xuống theo các kẽ nứt, tới trần hang gặp chướng ngại vật, nhỏ giọt rơi xuống đáy hang. Do không khí trong hang có nhiệt độ cao nên phân huỷ thành CaCO3, H2O, CO2 . CaCO3 là chất khó hòa tan kết tủa lại nơi giọt nước rơi xuống, cứ thế tạo thành các nhũ đá trên trần hang.
BÀI TẬP
Bài 1:
B
Bài 2:
D
Bài 3:
(1) 
(2) 
Bài 4:
Các yếu tố | Phản ứng a xảy ra theo chiều | Phản ứng b xảy ra theo chiều |
(1) Tăng nhiệt độ | Thuận | nghịch |
(2) Thêm lượng hơi nước vào hệ | thuận | thuận |
(3) Thêm khí H2 vào hệ | nghịch | nghịch |
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống | nghịch | không đổi |
(5) Dùng chất xúc tác | không đổi | không đổi |
Bài 5:
0,2744M
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 11 Chân trời sáng tạo, giải Hóa học 11 Chân trời sáng tạo trang 5, giải Hóa học 11 CTST trang 5
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận