5 phút giải Hóa học 11 Chân trời sáng tạo trang 124
5 phút giải Hóa học 11 Chân trời sáng tạo trang 124. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
CHƯƠNG 6. HỢP CHẤT CARBONYL (ALDEHYDE - KETONE) - CARBOXYLIC ACID
BÀI 19: CARBOXYLIC ACID
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Một số loại acid hữu cơ được dùng trong, thực phẩm như acetic acid, lactic acid. Thường gặp nhất là carboxylic acid, có nhiều trong tự nhiên như trong thành phần của các loại trái cây, chúng gây ra vị chua và một số mùi quen thuộc. Carboxylic acid là gi? Những tính chất nào đặc trưng cho carboxylic acid?
1. KHÁI NIỆM - CẤU TRÚC - DANH PHÁP
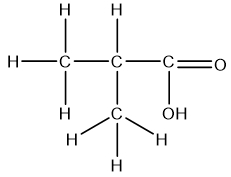
Bài 1: Quan sát hình 19.1, hãy nêu đặc điểm chung về cấu tạo của carboxylic acid, nêu đặc điểm khác về cấu tạo của carboxylic acid so với cấu tạo của aldehyde và ketone.
Bài 2: Hãy viết công thức cấu tạo của các carboxylic acid đơn chức có công thức phân tử C4H8O2
Bài 3: Hãy viết công thức cấu tạo của các carboxylic acid đơn chức có công thức phân tử C4H8O2
Bài 4: Hãy chỉ ra hợp chất carboxylic acid trong số các chất sau đây:
CH3CHO (1), C6H5OH (2), CH2 = CH - COOH (3), HOOC - COOH (4).
Bài 5: Dựa vào bảng 19.1, rút ra cách gọi tên carboxylic acid theo danh pháp thay thế.
2. TÍNH CHẤT VẬT LÍ
Bài 1: So sánh nhiệt độ sôi của butanoic acid với nhiệt độ sôi của các chất trong bảng sau. Giải thích.
Chất | Công thức | Nhiệt độ sôi |
Butane | CH3CH2CH2CH3 | - 0,5 |
Butanal | CH3CH2CH2CHO | 76 |
Butan - 1 - ol | CH3CH2CH2CH2OH | 117,7 |
Butanoic acid | CH3CH2CH2COOH | 163,0 |
Bài 2: Vì sao acetic acid tan vô hạn trong nước?
Bài 3: Hãy sắp xếp theo chiều tăng dần nhiệt độ sôi của các chất sau, giải thích.
(1) C3H8, (2) C2H5COOH, (3) C2H5CHO, (4) C3H7OH
3. TÍNH CHẤT HOÁ HỌC
Bài 1: Từ đặc điểm cấu tạo nhóm carboxyl, dự đoán tính chất hóa học đặc trưng của hợp chất carboxylic acid
Bài 2: Biết Ka (hằng số phân li) acid của R - COOH được tính theo biểu thức sau
Dựa vào Bảng 19.3 nhận xét về tính acid của carboxylic acid. Nêu tính chất hóa học đặc trưng của chúng.
Bài 3: Tiến hành thí nghiệm 1 theo hướng dẫn. Nêu hiện tượng xảy ra. Giải thích và viết phương trình hóa học của phản ứng
Bài 4: Hãy lựa chọn hóa chất hợp lí để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng. Giải thích.
Bài 5: Hoàn thành các phương trình hóa học của các phản ứng sau
a) (CH3)2CHCOOH + Ca →
b) HOOC - COOH + NaOH →
c) HCOOH + Na2CO3 →
d) C2H5COOH + CuO →
Bài 6: Trình bày cách phân biệt các dung dịch sau bằng phương pháp hóa học: ethanol, acetaldehyde, acetic acid và acrylic acid
Bài 7: Tiến hành thí nghiệm 2 theo các bước. Quan sát, nêu hiện tượng. Dấu hiệu nào giúp nhận biết có sản phẩm mới được tạo thành? Giải thích
Bài 8: Nêu vai trò của dung dịch H2SO4 đặc, đá bột, dung dịch NaCl bão hòa.
Bài 9: Nêu một số biện pháp để nâng cao hiệu suất của phản ứng
Bài 10: Viết phản ứng tạo thành ester có công thức CH3COOCH3 từ acid và alcohol tương ứng. Tìm hiểu ứng dụng của ester trong thực tiễn.
4. ỨNG DỤNG CỦA MỘT SỐ CARBOXYLIC ACID THÔNG DỤNG
Bài 1: Quan sát hình 19.5, nêu một số ứng dụng của carboxylic acid
5. ĐIỀU CHẾ
Bài 1: Phương pháp điều chế acetic acid bằng cách lên men giấm cần thực hiện trong những điều kiện nào? Giải thích. Nêu ứng dụng trong thực tiễn của phương pháp trên.
Bài 2: Tìm hiểu phương pháp lên men giấm và thực hành làm giấm ăn từ các nguyên liệu có sẵn để sử dụng trong gia đình.
BÀI TẬP
Bài 1: Viết phương trình hóa học các phản ứng xảy ra theo sơ đồ sau, ghi rõ điều kiện phản ứng (nếu có)
CH2 = CH2 → CH3CH2OH → CH3COOC2H5
Bài 2: Xác định các chất X, Y, Z và hoàn thành các phản ứng sau
a) sodium hydroxide + X → sodium methanoate + nước
b) 3-methylbutanoic acid + Mg → Y + Z
Bài 3: Bằng kiến thức hoá học, em hãy giải thích các cách làm sau đây:
a) Khi đồ dùng có đốm gỉ, sử dụng giấm để lau chùi, vết gỉ sẽ hết.
b) Khi thực hiện lên men rượu cần ủ kín, còn khi lên men giấm cần để thoáng.
Bài 4: Điều chế ethyl acetate bằng cách cho 6 gam acetic acid tác dụng với 5,2 gam ethanol cứ xúc tác là dung dịch sulfuric acid đặc và đun nóng, thu được 5,28 gam ester. Tính hiệu suất của phản ứng.
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
Carboxylic acid là những hợp chất hữu cơ mà phân tử có nhóm carboxyl - COOH liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydro.
Tính acid, phản ứng ester hoá
1. KHÁI NIỆM - CẤU TRÚC - DANH PHÁP
Bài 1:
Đặc điểm chung carboxylic acid: chứa – COOH
Đặc điểm khác: là carboxylic acid có -OH liên kết với C=O
Bài 2:
CH3 - CH2 – CH2 – COOH
CH3 – CH(CH3)COOH
Bài 3:
Công thức cấu tạo | Công thức cấu tạo thu gọn |
| CH3 - CH2 – CH2 – COOH |
| CH3 – CH(CH3)COOH |
Bài 4:
(3), (4).
Bài 5:
Số chỉ vị trí mạch nhánh - Tên nhánh + Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
2. TÍNH CHẤT VẬT LÍ
Bài 1:
Lớn hơn nhiệt độ sôi của các chất trong bảng. Do butanoic acid có liên kết hydrogen bền vững hơn
Bài 2:
Vì mạch ngắn, phân tử khối nhỏ và có khả năng tạo liên kết hydrogen với nước .
Bài 3:
(1) < (3) < (4) < (2)
3. TÍNH CHẤT HOÁ HỌC
Bài 1:
Carboxylic acid thể hiện tính acid và tham gia phản ứng ester hoá.
Bài 2:
Tính acid giảm dần theo độ tăng chiều dài mạch C
Bài 3:
Hiện tượng: Quỳ tím chuyển đỏ.
Khi cho magnesium: kim loại tan, dung dịch màu không màu và có khí thoát ra.
2CH3COOH + Mg → (CH3COO)2Mg + H2
Khi cho Na2CO3: dung dịch không màu và có khí thoát ra.
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
Bài 4:
Giấm ăn. Trong giấm ăn có acetic acid. Có thể tác dụng với lớp cặn.
Bài 5
a) 2(CH3)2CHCOOH + Ca → ((CH3)2CHCOO)2Ca + H2
b) HOOC - COOH + 2NaOH → NaOOC - COONa + 2H2O
c) 2HCOOH + Na2CO3 → 2HCOONa + CO2 + H2O
d) 2C2H5COOH + CuO → (C2H5COO)2Cu + H2O
Bài 6:
- Cho quỳ tím : acetic acid và acrylic acid sẽ đổi màu quỳ tím thành đỏ (nhóm 1)
- Nhỏ dung dịch bromine: acrylic acid sẽ làm mất màu nước bromine.
- Cu(OH)2/NaOH: acetaldehyde xuất hiện kết tủa đỏ gạch,
- Còn lại ethanol không hiện tượng
Bài 7:
Hiện tượng: dung dịch phân thành hai lớp, mùi thơm
Dấu hiệu : mùi thơm, không tan trong nước, nổi trên mặt nước.
Bài 8:
- H₂SO₄ đặc : xúc tác, chất hút nước => tăng hiệu suất phản ứng điều chế ester
- NaCl bão hoà : tách lớp dung dịch (hay là để ester tách ra).
- Đá bọt là để dung dịch sôi đều, tránh sôi một cách cục bộ
Bài 9:
Tăng nồng độ các chất tham gia phản ứng hoặc giảm nồng độ các chất sản phẩm, dùng xúc tác H2SO4 đặc.
Duy trì nhiệt độ 65 - 70 độ C
Bài 10:
CH3COOH + CH3OH ⇌ H2O + CH3COOCH3
Ứng dụng :
- Trong sản xuất sơn, keo dán, chất tẩy sơn móng tay
- Tham gia tổng hợp các hóa chất
- Trong y dược: Methyl acetate như một dung môi ly trích cho các chất kháng sinh nặng, các loại dược phẩm thô.
- Làm chất phụ gia tạo mùi hương.
4. ỨNG DỤNG CỦA MỘT SỐ CARBOXYLIC ACID THÔNG DỤNG
Bài 1:
- Tổng hợp hữu cơ, polymer
- Sản xuất xà phòng
- Sản xuất mĩ phẩm, dược phẩm, phẩm nhuộm,
- Bảo quản thực phẩm
- Công nghệ dệt,...
5. ĐIỀU CHẾ
Bài 1:
Điều kiện:
- Thoáng khí
- Nhiệt độ thích hợp 20oC - 30oC
Ứng dụng: sản xuất giấm ăn.
Bài 2:
Cách làm giấm táo
Nguyên liệu: Táo thường: 3 kg, Giấm gạo: 1 lít , Đường phèn: 1 bát, Hũ thủy tinh đựng giấm
- Bước 1 : Táo rửa sạch.
- Bước 2 : Cắt táo thành từng miếng nhỏ
- Bước 3 : Hũ thủy tinh rửa sạch, để khô.
Cách làm
- Bước 1 : xếp một lớp táo đến một lớp đường như vậy cho đến hết. Kết thúc bằng một lớp đường trên cùng.
- Bước 2 : Đổ giấm gạo cho ngập táo
- Bước 3 : Đậy kín nắp hũ sau đó đặt ở nơi thoáng mát và ít ánh sáng trong khoảng 2 tháng.
- Bước 4 : Trong thời gian làm giấm, thỉnh thoảng bạn nên mở nắp hũ để giấm bay bớt mùi men sau đó đậy lại.
- Bước 5 : Sau 2 tháng lọc bỏ phần bã táo và lấy phần nước giấm cho vào một hũ thủy tinh khác. Tiếp tục để hũ thủy tinh vào một góc thoáng mát trong nhà trong khoảng 6 tuần tiếp theo, sau đó lấy ra và dùng.
BÀI TẬP
Bài 1:
CH2 = CH2 + H2O → CH3CH2OH
CH3CH2OH + CH3COOH ⇌ CH3COOC2H5 + H2O
Bài 2:
a) HCOOH
b) ((CH3)2CHCH2COO)Mg (Y) + H2 (Z)
Bài 3:
a) Giấm ăn có tính acid, có khả năng hòa tan được các oxide này nên sẽ giúp loại bỏ vết gỉ sét.
b) Vì men rượu hoạt động không cần oxygen không khí, nó chuyển hoá đường thành rượu và khí carbonic.
Men giấm thì cần oxygen để oxi hoá rượu thành giấm.
Bài 4:
60%.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 11 Chân trời sáng tạo, giải Hóa học 11 Chân trời sáng tạo trang 124, giải Hóa học 11 CTST trang 124
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều


Bình luận