Siêu nhanh giải bài 12 Hóa học 12 Chân trời sáng tạo
Giải siêu nhanh bài 12 Hóa học 12 Chân trời sáng tạo. Giải siêu nhanh Hóa học 12 Chân trời sáng tạo. Những phần nào có thể rút gọn, lược bỏ và tóm gọn. Đều được áp dụng vào bài giải này. Thêm cách giải mới để học sinh lựa chọn. Để tìm ra phong cách học Hóa học 12 Chân trời sáng tạo phù hợp với mình.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 12. THẾ ĐIỆN CỰC VÀ NGUỒN ĐIỆN HOÁ HỌC
MỞ ĐẦU
Người ta dùng hai sợi dây làm bằng hai kim loại khác nhau cắm vào một quả chanh và nối với một bóng đèn 3V thì thấy bóng đèn sáng. Như vậy, quả chanh có cắm hai sợi dây kim loại khác nhau đóng vai trò như một viên pin, phát sinh ra dòng điện.
Cấu tạo và nguyên tắc hoạt động của pin như thế nào?
Giải rút gọn:
- Cấu tạo: hai điện cực, mỗi điện cực ứng với một cặp oxi hoá – khử, nối với nhau qua cầu muối.
- Nguyên tắc hoạt động: ở anode xảy ra quá trình oxi hoá, ở cathode xảy ra quá trình khử.
1. CẶP OXI HOÁ – KHỬ CỦA KIM LOẠI
Thảo luận 1: Xác định dạng oxi hoá và dạng khử trong các quá trình (2) và (3).
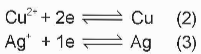
Giải rút gọn:
(2): dạng oxi hoá là Cu2+, dạng khử là Cu.
(3): dạng oxi hoá là Ag+, dạng khử là Ag
Thảo luận 2: Viết các cặp oxi hoá – khử trong quá trình (2) và (3).

Giải rút gọn:
- Quá trình (2): Cu2+/Cu.
- Quá trình (3): Ag+/Ag.
Luyện tập: Viết các cặp oxi hoá – khử của kim loại Na, Mg và Al.
Giải rút gọn:
- Na: Na+/Na.
- Mg: Mg2+/Mg.
- Al: Al3+/Al.
2. THẾ ĐIỆN CỰC CHUẨN CỦA KIM LOẠI VÀ PIN GALVANI
Thảo luận 3: Quan sát Hình 12.1, hãy mô tả cấu tạo của pin Galvani. Cho biết cực dương, cực âm và chiều di chuyển của electron trong pin.
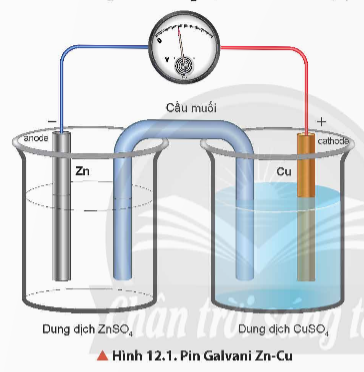
Giải rút gọn:
- Pin Galvani Zn-Cu gồm điện cực kẽm và điện cực đồng được nối với nhau bởi cầu muối.
- Cực dương: Cu, cực âm: Zn.
- Chiều di chuyển của electron trong pin: đi từ cực âm sang cực dương
Thảo luận 4: Điện cực nào bị tan dần trong pin Galvani Zn-Cu?
Giải rút gọn:
Là điện cực âm Zn.
3. Ý NGHĨA CỦA DÃY THẾ ĐIỆN CỰC CHUẨN KIM LOẠI
Thảo luận 5: Dựa vào Bảng 12.1, hãy sắp xếp theo chiều tăng dần tính oxi hoá của các ion Li+, Fe2+, Ag+ và chiều tăng dần tính khử của các kim loại tương ứng.
Giải rút gọn:
- Theo tính oxi hoá: Li+, Fe2+, Ag+.
- Theo tính khử: Ag+, Fe2+, Li+.
Thảo luận 6: Cho Al và Ag vào dung dịch HCl 1 M. Dựa vào Bảng 12.1, dự đoán phản ứng nào có thể xảy ra. Viết phương trình hoá học của phản ứng (nếu có).
Giải rút gọn:
Phản ứng có thể xảy ra là cho Al vào dung dịch HCl 1 M.
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2↑
Thảo luận 7: Dựa vào Bảng 12.1, xác định cathode và anode trong pin điện hoá Zn-Pb gồm điện cực chuẩn Zn2+/Zn và điện cực chuẩn Pb2+/Pb. Tính sức điện động chuẩn của pin.
Giải rút gọn:
- Cathode: Pb, anode: Zn.
- Ta có: ![]() . Vậy sức điện động chuẩn của pin là:
. Vậy sức điện động chuẩn của pin là: ![]()
4. MỘT SỐ LOẠI PIN KHÁC
Thảo luận 8: Hãy nêu một số ứng dụng của pin mặt trời trong đời sống.
Giải rút gọn:
Ví dụ: chiếu sáng công cộng, đèn giao thông, phương tiện giao thông, vệ tinh,…
Thảo luận 9: Hãy nêu một số thiết bị sử dụng acquy mà em biết.
Giải rút gọn:
Ví dụ: xe máy, ô tô, đèn thắp sáng,…
Thảo luận 10: Tìm hiểu và nêu ưu, nhược điểm của pin nhiên liệu, pin mặt trời và acquy.
Giải rút gọn:
- Pin nhiên liệu:
+ Ưu: nhiên liệu được bổ sung liên tục nên thời gian hoạt động không bị hạn chế.
+ Nhược: công nghệ chưa được phổ biến và giá thành cao.
- Pin mặt trời:
+ Ưu: nguồn năng lượng xanh thân thiện với môi trường, thời gian sử dụng lâu.
+ Nhược: cần không gian rộng để lắp đặt, khó di chuyển.
- Acquy:
+ Ưu: dung lượng, tuổi thọ, khả năng chịu tải cao và tích hợp với nhiều thiết bị.
+ Nhược: thời gian sạc lâu, trọng lượng nặng, giá thành cao,…
Vận dụng: Lắp ráp thêm một số pin đơn giản từ các nguyên liệu khác và đo sức điện động của pin.
Giải rút gọn:
Dụng cụ: 1 đồng xu, giấy bạc, giấy bìa cứng, dây dẫn. Nguyên liệu: giấm ăn.
Tiến hành:
- Cắt những miếng giấy carton có kích thước vừa bằng đồng xu, cắt giấy bạc thành nhiều miếng tương tự như giấy carton.
- Ngâm giấy carton vào giấm ăn sao cho giấm ngấm đều các mặt của giấy.
- Tiến hành xếp theo thứ tự tiền xu – giấy ngâm giấm – giấy bạc.
- Tiến hành ghi nhận giá trị sức điện động của pin là: 0,987 V.
BÀI TẬP
Bài 1: Cho các kim loại: K, Mg, Al, Ag. Hãy viết các cặp oxi hoá – khử tạo bởi các kim loại đó và dựa vào bảng giá trị thế điện cực chuẩn, sắp xếp theo thứ tự giảm dần tính oxi hoá của các ion kim loại tương ứng.
Giải rút gọn:
- Các cặp oxi hoá – khử: K+/K, Mg2+/Mg, Al3+/Al, Ag+/Ag.
- Thứ tự giảm dần là: Ag+, Al3+, Mg2+, K+.
Bài 2: Xác định chiều của các phản ứng hoá học xảy ra giữa các cặp oxi hoá – khử: Cu2+/Cu, Zn2+/Zn và Ag+/Ag ở điều kiện chuẩn. Giải thích và viết phương trình hoá học.
Giải rút gọn:
- Cu2+/Cu và Zn2+/Zn
Ta có: ![]() = -0,76 V <
= -0,76 V < ![]() = 0,34 V
= 0,34 V
PTHH: Zn + Cu2+ → Zn2+ + Cu
- Cu2+/Cu và Ag+/Ag
Ta có: ![]() = 0,34 V <
= 0,34 V < ![]() = 0,80 V
= 0,80 V
PTHH: Cu + Ag+ → Cu2+ + Ag
- Zn2+/Zn và Ag+/Ag
Ta có: ![]() = -0,76 V <
= -0,76 V < ![]() = 0,80 V
= 0,80 V
PTHH: Zn + Ag+ → Zn2+ + Ag
Bài 3: Trong pin điện hoá, quá trình khử
A. xảy ra ở cực âm. B. xảy ra ở cực dương.
C. xảy ra ở cực âm và cực dương. D. không xảy ra ở cả cực âm và cực dương.
Giải rút gọn:
Chọn đáp án B vì theo định nghĩa pin điện hoá.
Bài 4: Khi pin Galvani Zn-Cu hoạt động thì nồng độ
A. Cu2+ giảm, Zn2+ tăng. B. Cu2+ giảm, Zn2+ giảm.
C. Cu2+ tăng, Zn2+ tăng. D. Cu2+ tăng, Zn2+ giảm.
Giải rút gọn:
Chọn đáp án A vì:
- Điện cực Zn bị oxi hoá: Zn → Zn2+ + 2e nên đóng vai trò cực âm, các electron theo dây dẫn đến cực Cu, khối lượng điện cực Zn giảm, nồng độ Zn2+ tăng.
- Trong cốc đựng dung dịch CuSO4, các ion Cu2+ di chuyển đến thanh Cu, kh đó Cu2+ + 2e → Cu. Nồng độ Cu2+ trong dung dịch giảm dần làm màu xanh trong dung dịch nhạt dần.
Bài 5: Cho một pin điện hoá được tạo bởi các cặp oxi hoá khử Fe2+/Fe, Ag+/Ag ở điều kiện chuẩn. Quá trình xảy ra ở cực âm khi pin hoạt động là
A. Fe → Fe2+ + 2e B. Fe2+ +2e → Fe
C. Ag+ + 1e → Ag D. Ag → Ag+ + 1e
Giải rút gọn:
Chọn đáp án C vì ở cực âm Ag xảy ra quá trình oxi hoá.
Bài 6: Dựa vào Bảng 12.1, tính sức điện động chuẩn của các pin điện hoá tạo bởi các cặp oxi hoá – khử sau: Fe2+/Fe và Cu2+/Cu; Sn2+/Sn và Ag+/Ag; Pb2+/Pb và Ag+/Ag.
Giải rút gọn:
- Fe2+/Fe và Cu2+/Cu: ![]()
- Sn2+/Sn và Ag+/Ag: ![]()
- Pb2+/Pb và Ag+/Ag: ![]()
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải Hóa học 12 Chân trời sáng tạo bài 12, Giải bài 12 Hóa học 12 Chân trời sáng tạo, Siêu nhanh giải bài 12 Hóa học 12 Chân trời sáng tạo
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều


Bình luận