5 phút giải Khoa học tự nhiên 7 Cánh diều trang 33
5 phút giải Khoa học tự nhiên 7 Cánh diều trang 33. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 5. GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Câu hỏi: Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron ngoài cùng bền vững. Nguyên tử của các nguyên tố khác luôn có xu hướng tham gia liên kết để có được lớp electron ngoài cùng bền vững tương tự khí hiếm. Vậy liên kết giữa các nguyên tử được hình thành như thế nào?

I. ĐẶC ĐIỂM CẤU TẠO VỎ NGUYÊN TỬ KHÍ HIẾM
Câu 1: Quan sát hình 5.1 hãy cho biết số electron ở lớp ngoài cùng của vỏ nguyên tử khí hiếm
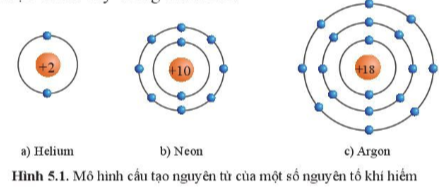
Tìm hiểu thêm: Helium được phát hiện vào năm 1868, khi các nhà khoa học nhận thấy một nguyên tố chưa được biết đến trong quang phổ ánh sáng từ Mặt Trời. Helium được đặt theo tên của thần Mặt Trời – Helios (theo tiếng Hy Lạp). Tuy nhiên, phải thới năm 1895, các nhà khoa học mới thu được helium trong quá trình xử lí quặng uranium. Mặc dù trong vũ trụ, helium là khí phổ biến thứ hai sau khí hydrogen, nhưng trên Trái Đất khí helium tương đối hiếm. Hãy tìm hiểu một số ứng dụng của helium trong thực tiễn
II. LIÊN KẾT ION
1. Sự tạo thành liên kết trong phân tử sodium chloride
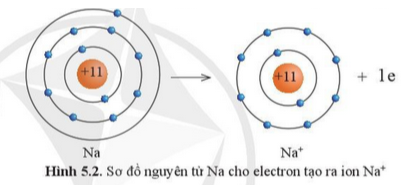
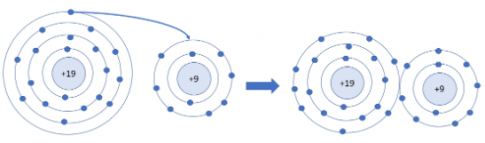
Câu 2: Quan sát hình 5.2 và 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào?
Câu 3: Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và Na+
Câu hỏi 1: Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K hết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride
2. Sự tạo thành liên kết trong phân tử magnesium oxide
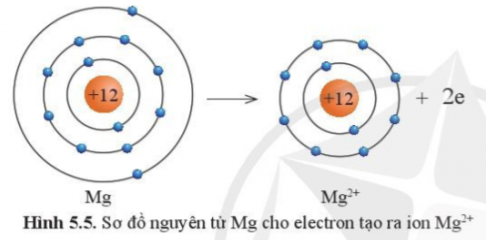
Câu 4: Quan sát hình 5.5 và 5.6 và cho biết các ion Mg2+ và O2- có lớp vỏ tương đương khí hiếm nào?
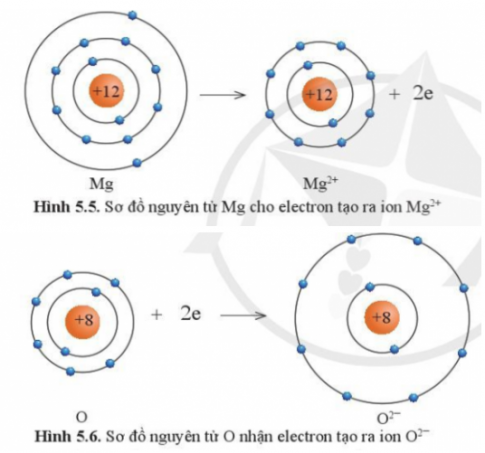
Câu 5: Quan sát hình 5.5 hãy so sánh về số electron, số lớp electron giữa nguyên tử Mg và ion Mg2+
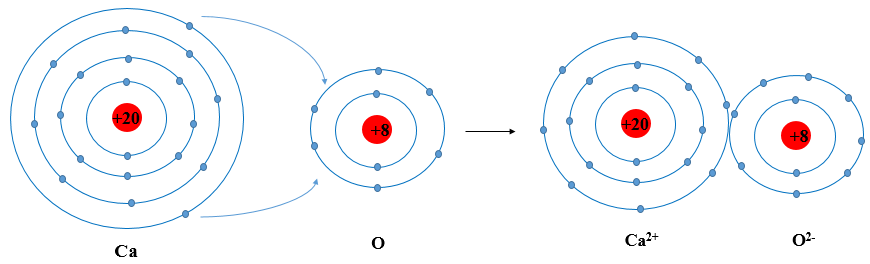
Câu hỏi 2: Nguyên tử Ca có 2 electron ở lớp ngoài cùng. Hãy vẽ sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide
Câu hỏi 3: Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Theo em, ở điều kiện thường, potassium chloride là chất rắn, chất lỏng hay chất khí? Vì sao?
III. LIÊN KẾT CỘNG HOÁ TRỊ
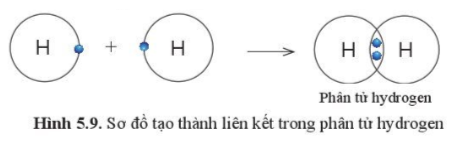
1. Sự tạo thành liên kết trong phân tử hydrogen
Câu 6: Quan sát hình 5.9 , hãy cho biết nguyên tử H trong phân tử Hydrogen có lớp vỏ tương tự khí hiếm nào?
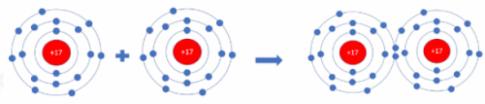
Câu hỏi 4: Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine
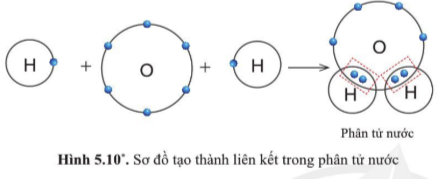
2. Sự tạo thành liên kết trong phân tử nước
Câu 7: Quan sát hình 5.10, trong phân tử nước, mỗi nguyên tử H và O có bao nhiêu electron ở lớp ngoài cùng
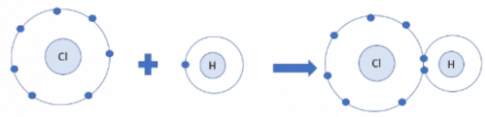
Câu hỏi 5: Mỗi nguyên tử H kết hợp với 1 nguyên tử Cl tạo thành phân tử hydrogen chloride. Hãy vẽ sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và nguyên tử Cl
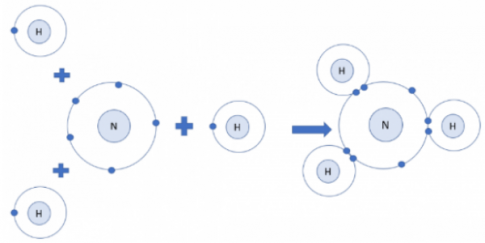
Câu hỏi 6: Mỗi nguyên tử N kết hợp với 3 nguyên tử H tạo thành phân tử ammonia. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử ammonia.
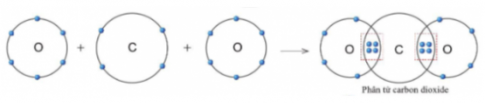
3. Sự tạo thành liên kết trong phân tử carbon dioxide
Câu 8: Quan sát hình 5.11, hãy cho biết trong phân tử khí carbon dioxide, nguyên tử cacbon có bao nhiêu electron dùng chung với nguyên tử O
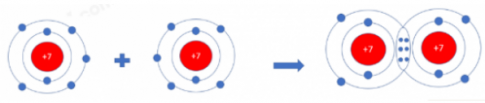
Câu hỏi 7: Hai nguyên tử N kết hợp với nhau tạo thành phân tử nitrogen. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử nitrogen
VẬN DỤNG
Câu hỏi: Hãy giải thích các hiện tượng sau:
a) Nước tinh khiết hầu như không dẫn điện, nhưng nước biển lại dẫn được điện.
b) Khi cho đường ăn vào chảo rồi đun nóng sẽ thấy đường ăn nhanh chóng chuyển từ thể rắn sang thể lỏng, làm như vậy với muối ăn thấy muối ăn vẫn ở thể rắn
Câu 9: So sánh một số tính chất chung của chất cộng hoá trị với chất ion
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
I. ĐẶC ĐIỂM CẤU TẠO VỎ NGUYÊN TỬ KHÍ HIẾM
Câu 1:
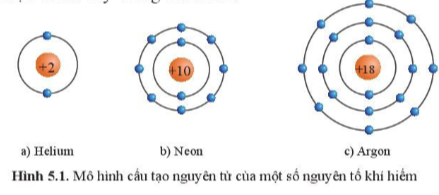
Đều có 8 electron (trừ He là 2 electron).
Tìm hiểu thêm:
Bảo vệ các mối hàn tốt, tránh oxy hoá, han gỉ, làm sạch bồn chứa, làm chất bán dẫn…
II. LIÊN KẾT ION
1. Sự tạo thành liên kết trong phân tử sodium chloride
Câu 2:
- Lớp vỏ ion Na+ tương tự Ne.
- Lớp vỏ ion Cl- tương tự Aron.
Câu 3:
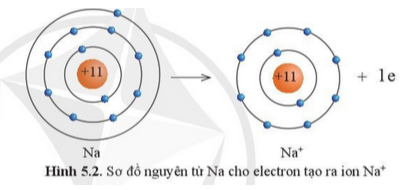
Nguyên tử Na đã mất đi 1 electron để tạo thành ion Na+
Câu hỏi 1:
- Nguyên tử K cho đi 1 electron.
- Sơ đồ:
2. Sự tạo thành liên kết trong phân tử magnesium oxide
Câu 4:
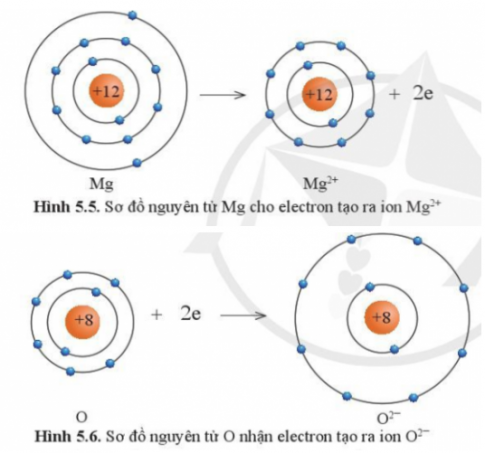
Tương đương Ne.
Câu 5:
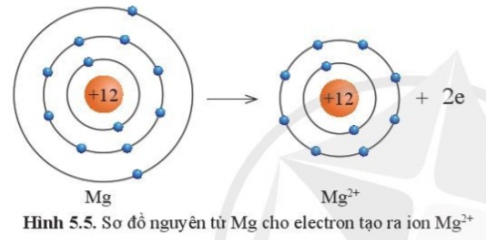
Số electron và số lớp electron của nguyên tử Mg nhiều hơn ion Mg2+
Câu hỏi 2:
- Nguyên tử Ca cho đi 2 electron lớp ngoài cùng ® Ca2+. Nguyên tử O nhận 2 electron từ nguyên tử Ca ® O2-.
- Sơ đồ:
Câu hỏi 3:
Potassium chloride là chất rắn ở điều kiện thường.
III. LIÊN KẾT CỘNG HOÁ TRỊ
1. Sự tạo thành liên kết trong phân tử hydrogen
Câu 6:
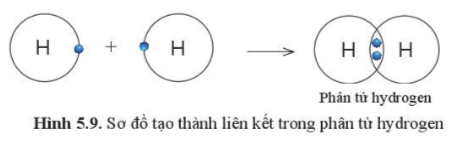
Heli.
Câu hỏi 4:
a) Nhận thêm 1 electron vào lớp vỏ ngoài cùng.
b) Sơ đồ:
2. Sự tạo thành liên kết trong phân tử nước
Câu 7
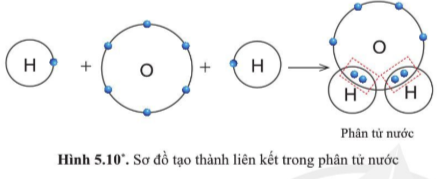
Nguyên tử H có 2 electron, O có 8 electron ở lớp ngoài cùng.
Câu hỏi 5:
Sơ đồ:
Câu hỏi 6:
Sơ đồ:
3. Sự tạo thành liên kết trong phân tử carbon dioxide
Câu 8:
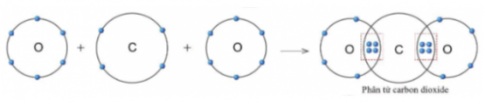
4 electron
Câu hỏi 7:
Sơ đồ:
VẬN DỤNG
Câu hỏi:
a) Nước không dẫn điện vì là hợp chất cộng hóa trị. Nước biển dẫn điện vì có thành phần là muối ăn (NaCl) là hợp chất ion.
b) Đường ăn là hợp chất cộng hóa trị ® Nhiệt độ nóng chảy thấp ® đun nóng chuyển rắn sang lỏng. Muối ăn là hợp chất ion ® Nhiệt độ nóng chảy cao ® đun nóng trên chảo vẫn ở thể rắn.
Câu 9:
| Chất cộng hóa trị | Chất ion |
| Ở điều kiện thường: rắn, lỏng, khí | Ở điều kiện thường: thể rắn. |
| Nhiệt độ sôi, nhiệt độ nóng chảy thấp | Nhiệt độ sôi, nhiệt độ nóng chảy thấp |
| Không dẫn điện | Khi tan trong nước tạo ra dung dịch dẫn được điện |
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Khoa học tự nhiên 7 Cánh diều, giải Khoa học tự nhiên 7 Cánh diều trang 33, giải KHTN 7 CD trang 33

Bình luận