5 phút giải Hóa học 10 Cánh diều trang 70
5 phút giải Hóa học 10 Cánh diều trang 70. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 13: PHẢN ỨNG OXI HOÁ – KHỬ
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Quá trình bị gỉ của đinh ốc ngoài không khi được mô tả như hình dưới đấy:
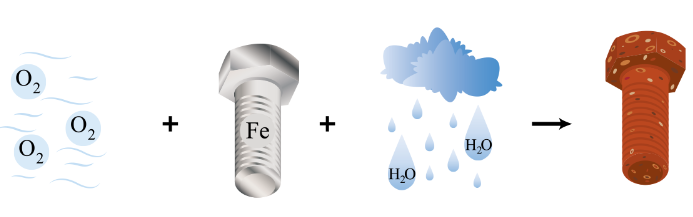
Trong quá trình này, hãy cho biết nguyên tử nguyên tố nào nhường electron, nguyên tử nguyên tố nào nhận electron. Giải thích.
I. SỐ OXI HOÁ
Luyện tập 1: Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2.
Luyện tập 2: Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: NO, CH4
Câu 1: Dựa theo quy tắc octet, giải thích vì sao số oxi hóa của O là -2, của kim loại nhóm IA là +1, của kim loại nhóm IIA là +2 và của Al là +3.
Luyện tập 3: Xác định số oxi hóa của mỗi nguyên tử trong các hợp chất: Fe2O3, Na2CO3, KAl(SO4)2
Luyện tập 4: Xác định số oxi hóa của mỗi nguyên tử trong các ion NO3-, NH4+, MnO4-.
Luyện tập 5: Xác định số oxi hóa của mỗi nguyên tử trong NH3 theo cách 2.
Câu 2: Dựa vào độ âm điện, giải thích vì sao công thức ion giả định của OF2 là F-O2+F- mà không phải là F+O2-F+.
II. PHẢN ỨNG OXI HOÁ – KHỬ
Câu 3: Xác định số oxi hóa của các nguyên tử trong phản ứng (1), (2). Cho biết nguyên tố nào có sự thay đổi số oxi hóa.
Câu 4: Nguyên tố Cl thể hiện bao nhiêu số oxi hóa trong phản ứng (3)?
Câu 5: Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa.
Câu 6: Cân bằng các phản ứng oxi hóa – khử sau. Chỉ ra chất oxi hóa, chất khử, sự oxi hóa, sự khử.
a) Fe2O3 + CO → Fe + CO2
b) NH3 + O2 → NO + H2O
Câu 7: Các phản ứng trên thường gặp trong đời sống và trong sản xuất. Những phản ứng này thường diễn ra trong quá trình nào?
Luyện tập 6: Cân bằng các phản ứng oxi hóa – khử sau:
a) HCl + PbO2 → PbCl2 + Cl2 + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Vận dụng: Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên.
Câu 8: Hãy viết các quá trình thay đổi số oxi hóa của mỗi nguyên tử nguyên tố trong phản ứng oxi hóa hoàn toàn methane (thành phần chính của khí thiên nhiên)
BÀI TẬP
Bài 1: Xác định số oxi hóa của mỗi nguyên tử trong phân tử và ion sau đây:
a) H2SO3 b) Al(OH)4- c) NaAlH4 d) NO2-
Bài 2: Xác định chất oxi hóa, chất khử, viết quá trình oxi hóa, quá trình khử trong các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+
c) 2As + 3Cl2 → 2AsCl3
d*) Al + 6H+ + 3NO3- → Al3+ + 3NO2 + 3H2O
Bài 3: Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron:
a) NaBr + Cl2 → NaCl + Br2
b) Fe2O3 + CO → Fe + CO2
c) CO + I2O5 → CO2 + I2
d) Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O
e) H+ + MnO4- + HCOOH → Mn2+ + H2O + CO2
Bài 4: Nước oxi già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2).
a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử.
b) Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2. Viết quá trình khử minh họa cho nguyên tử nguyên tố đó.
Bài 5: Xăng E5 được tạo nên bởi sự pha trộn xăng A92 và ethanol (C2H5OH) theo tỉ lệ thể tích tương ứng là 95 : 5, giúp thay thế một phần nhiên liệu hóa thạch, phù hợp với xu thế phát triển chung trên thế giới và góp phần đảm bảo an ninh năng lượng quốc gia.
Viết phương trình của phản ứng hóa học đốt cháy ethanol thành CO2 và H2O. Phản ứng này có phải là phản ứng oxi hóa – khử hay không? Nó thuộc loại phản ứng cung cấp hay tích trữ năng lượng.
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
Fe nhường: Fe → Fe2+ + 2e. Oxygen nhận: 2H2O + O2 + 4e → 4OH-
I. SỐ OXI HOÁ
Luyện tập 1:
Al: +3, O: -2, Ca: +2, F: -1.
Luyện tập 2:
N: +2, O: -2, H: +1, C: -4.
Câu 1:
- Nguyên tử O có 6e lớp ngoài cùng nên nhận thêm 2e để đạt cấu hình khí hiếm.
- Nguyên tử kim loại nhóm IA có 1e lớp ngoài cùng nên nhường 1e để đạt cấu hình khí hiếm.
- Nguyên tử kim loại nhóm IIA có 2e lớp ngoài cùng nên nhường 2e để đạt cấu hình khí hiếm.
- Nguyên tử Al có 3e lớp ngoài cùng nên nhường 3e để đạt cấu hình khí hiếm.
Luyện tập 3:
- Fe2O3: Fe là +3, O là -2.
- Na2CO3: Na là +1, C là +4, O là +2.
- KAl(SO4)2: K là +1, Al là +3, S là +6, O là -2.
Luyện tập 4:
- NO3-: N là +5, O là -2.
- NH4+: N là -3, H là +1.
- MnO4-: Mn là +7, O là -2.
Luyện tập 5:
H góp 1e chuyển sang N. Có 3 liên kết N-H nên số OXH của N là +3, H là -1.
Câu 2:
Vì ĐÂĐ của F lớn hơn nên cặp e chung lệch về F.
II. PHẢN ỨNG OXI HOÁ – KHỬ
Câu 3:
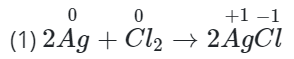
=> Ag và Cl có sự thay đổi
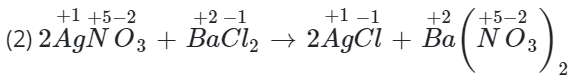
=> Không thay đổi.
Câu 4:
0, +1, -1.
Câu 5:
Quá tình OXH: Al → Al3+ + 3e => Al - chất khử
Quá trình khử: O2 + 4e → 2O2- => O2 - chất OXH.
Câu 6:
a) Quá trình khử: 2x|Fe3+ + 3e → Fe => Fe2O3 là chất OXH
Quá trình OXH: 3x|C+2 → C+4 + 2e => CO là chất khử
PTHH: Fe2O3 + 3CO → 2Fe + 3CO2
b) Quá trình khử: 4x| N+3 + 1e → N+2 => NH3 là chất OXH
Quá trình OXH: O2 + 4e → 2O2- => O2 là chất khử
PTHH: 4NH3 + 5O2 → 4NO + 6H2O
Câu 7:
a) Luyện gang.
b) Điều chế HNO3
Luyện tập 6:
a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
b) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Vận dụng:
Có. Biện pháp:
- Sơn, mạ, bôi dầu mỡ lên bề mặt,…
- Chế tạo hợp kim ít bị ăn mòn…
Câu 8:
O2 + 4e → 2O-2
C-4 → C+4 + 8e
BÀI TẬP
Bài 1:
a) O là -2, H là +1, S là +4
b) O là -2, H là +1, Al là +3
c) Na là +1, H là -1, Al là +3.
d) N là +3, O là -2.
Bài 2:
a) Quá trình khử: Ag+ + 1e → Ag => Ag+ là chất OXH
Quá trình OXH: Fe2+ → Fe3+ + 1e => Fe2+ là chất khử
b) Quá trình khử: Hg2+ + 2e → Hg => Hg2+ là chất OXH
Quá trình OXH: Fe → Fe+3 +3e => Fe là chất khử
c) Quá trình OXH: As → As3+ + 3e => As là chất khử
Quá trình khử: Cl2 + 2e → 2Cl => Cl2 là chất OXH
d) Quá trình khử: N+5 + 1e → N+4 => NO3- là chất OXH
Quá trình OXH: Al → Al+3 + 3e
Bài 3:
a) 2NaBr + Cl2 → 2NaCl + Br2
b) Fe2O3 + 3CO → 2Fe + 3CO2
c) 5CO + I2O5 → 5CO2 + I2
d) 2Cr(OH)3 + 3Br2 + 10OH- → 2CrO42- + 6Br- + 8H2O
e) 6H+ + 2MnO4- + 5HCOOH → 2Mn2+ + 8H2O + 5CO2
Bài 4:
a) O là -1, H là +1
b) Nguyên tử O vì khi này số oxi hóa của O là -1. Quá trình khử: O-1 + 1e → O-2
Bài 5:
- PTHH: C2H5OH + 3O2 ![]() 2CO2 + 3H2O
2CO2 + 3H2O
- Có, loại cung cấp năng lượng.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 10 Cánh diều, giải Hóa học 10 Cánh diều trang 70, giải Hóa học 10 CD trang 70

Bình luận