Dễ hiểu giải Hóa học 10 cánh diều bài 13: Phản ứng oxi hóa khử
Giải dễ hiểu bài 13: Phản ứng oxi hóa khử. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 10 Cánh diều dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 13: PHẢN ỨNG OXI HOÁ – KHỬ
MỞ ĐẦU
Quá trình bị gỉ của đinh ốc ngoài không khi được mô tả như hình dưới đấy:
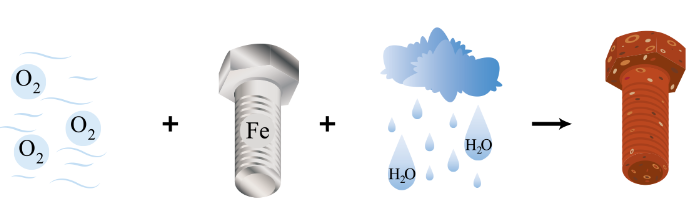
Trong quá trình này, hãy cho biết nguyên tử nguyên tố nào nhường electron, nguyên tử nguyên tố nào nhận electron. Giải thích.
Giải nhanh:
Fe nhường electron: Fe → Fe2+ + 2e
Oxygen của không khí nhận electron: 2H2O + O2 + 4e → 4OH-
I. SỐ OXI HOÁ
Luyện tập 1: Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2.
Giải nhanh:
Số oxi hóa của Al là +3, của O là -2, của Ca là +2, của F là -1.
Luyện tập 2: Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: NO, CH4
Giải nhanh:
Số oxi hóa của N là +2, O là -2, của H là +1, C là -4.
Giải nhanh:
- Nguyên tử O có 6 electron lớp vỏ ngoài cùng nên có xu hướng nhận thêm 2 electron để đạt được cấu hình khí hiếm
- Nguyên tử kim loại nhóm IA có 1 electron lớp vỏ ngoài cùng nên có xu hướng nhường 1 electron này để đạt được cấu hình khí hiếm.
- Nguyên tử kim loại nhóm IIA có 2 electron lớp vỏ ngoài cùng nên có xu hướng nhường 2 electron này để đạt được cấu hình khí hiếm.
- Nguyên tử Al có 3 electron lớp vỏ ngoài cùng nên có xu hướng nhường 3 electron này để đạt được cấu hình khí hiếm.
Luyện tập 3: Xác định số oxi hóa của mỗi nguyên tử trong các hợp chất: Fe2O3, Na2CO3, KAl(SO4)2
Giải nhanh:
- Fe2O3: số oxi hóa của Fe là +3, O là -2.
- Na2CO3: số oxi hóa của Na là +1, C là +4, O là +2.
- KAl(SO4)2: số oxi hóa của K là +1, Al là +3, S là +6, O là -2.
Luyện tập 4: Xác định số oxi hóa của mỗi nguyên tử trong các ion NO3-, NH4+, MnO4-.
Giải nhanh:
- NO3-: số oxi hóa của N là +5, O là -2.
- NH4+: số oxi hóa của N là -3, H là +1.
- MnO4-: số oxi hóa của Mn là +7, O là -2.
Luyện tập 5: Xác định số oxi hóa của mỗi nguyên tử trong NH3 theo cách 2.
Giải nhanh:
Trong mỗi liên kết đơn, H góp 1 electron chuyển sang N. Có 3 liên kết N-H nên số oxi hóa của N là +3, H là -1.
Giải nhanh:
Vì độ âm điện của F lớn hơn nên 2 cặp electron chung sẽ lệch hoàn toàn về F.
II. PHẢN ỨNG OXI HOÁ – KHỬ
Giải nhanh:
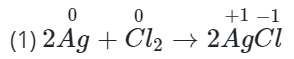
Cả Ag và Cl đều có sự thay đổi số oxi hóa

Không có sự thay đổi số oxi hoá.
Câu 4: Nguyên tố Cl thể hiện bao nhiêu số oxi hóa trong phản ứng (3)?
Giải nhanh:
3 số oxi hóa của Cl là 0, +1, -1.
Câu 5: Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa.
Giải nhanh:
Quá tình oxi hoá: Al → Al3+ + 3e => Al là chất khử
Quá trình khử: O2 + 4e → 2O2- => O2 là chất oxi hoá.
Câu 6: Cân bằng các phản ứng oxi hóa – khử sau. Chỉ ra chất oxi hóa, chất khử, sự oxi hóa, sự khử.
a) Fe2O3 + CO → Fe + CO2
b) NH3 + O2 → NO + H2O
Giải nhanh:
a) Quá trình khử: 2x| Fe3+ + 3e → Fe => Fe2O3 là chất oxi hoá
Quá trình oxi hoá: 3x| C+2 → C+4 + 2e => CO là chất khử
PTHH: Fe2O3 + 3CO → 2Fe + 3CO2
b) Quá trình khử: 4x| N+3 + 1e → N+2 => NH3 là chất oxi hoá
Quá trình oxi hoá: O2 + 4e → 2O2- => O2 là chất khử
PTHH: 4NH3 + 5O2 → 4NO + 6H2O
Giải nhanh:
a) Diễn ra trong quá trình luyện gang.
b) Diễn ra trong quá trình điều chế HNO3
Luyện tập 6: Cân bằng các phản ứng oxi hóa – khử sau:
a) HCl + PbO2 → PbCl2 + Cl2 + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Giải nhanh:
a) 2Cl-1 → Cl2 +2e
Pb+4 + 2e → Pb+2
PTHH: 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
b) 2x| Mn+7 + 5e → Mn+2
5x| 2Cl-1 → Cl2 +2e
PTHH: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Giải nhanh:
Là phản ứng oxi hoá – khử. Một số biện pháp:
- Sơn, mạ, bôi dầu mỡ lên trên bề mặt,…
- Chế tạo hợp kim ít bị ăn mòn…
Giải nhanh:
O2 + 4e → 2O-2
C-4 → C+4 + 8e
BÀI TẬP
Bài 1: Xác định số oxi hóa của mỗi nguyên tử trong phân tử và ion sau đây:
a) H2SO3 b) Al(OH)4- c) NaAlH4 d) NO2-
Giải nhanh:
a) Số oxi hóa của O là -2, H là +1, S là +4
b) Số oxi hóa của O là -2, H là +1, Al là +3
c) Số oxi hóa của Na là +1, H là -1, Al là +3.
d) Số oxi hóa của N là +3, O là -2.
d*) Al + 6H+ + 3NO3- → Al3+ + 3NO2 + 3H2O
Giải nhanh:
a) Quá trình khử: Ag+ + 1e → Ag => Ag+ là chất oxi hoá
Quá trình oxi hoá: Fe2+ → Fe3+ + 1e => Fe2+ là chất khử
b) Quá trình khử: Hg2+ + 2e → Hg => Hg2+ là chất oxi hoá
Quá trình oxi hóa: Fe → Fe+3 +3e => Fe là chất khử
c) Quá trình oxi hoá: As → As3+ + 3e => As là chất khử
Quá trình khử: Cl2 + 2e → 2Cl => Cl2 là chất oxi hoá
d) Quá trình khử: N+5 + 1e → N+4 => NO3- là chất oxi hoá
Quá trình oxi hóa: Al → Al+3 + 3e
Bài 3: Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron:
d) Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O
e) H+ + MnO4- + HCOOH → Mn2+ + H2O + CO2
Giải nhanh:
a) Cl2 + 2e → 2Cl-
2Br- → Br2 + 2e
PTHH: 2NaBr + Cl2 → 2NaCl + Br2
b) 2x| Fe+3 + 3e → Fe
3x| C+2 → C+4 + 2e
PTHH: Fe2O3 + 3CO → 2Fe + 3CO2
c) 2I+5 + 10e → I2
5x| C+2 → C+4 + 2e
PTHH: 5CO + I2O5 → 5CO2 + I2
d) 2x| Cr+3 → Cr+6 + 3e
3x| Br2 + 2r → 2Br-
PTHH: 2Cr(OH)3 + 3Br2 + 10OH- → 2CrO42- + 6Br- + 8H2O
e) 2x| Mn+7 + 5e → Mn+2
5x| C+2 → C+4 + 2e
PTHH: 6H+ + 2MnO4- + 5HCOOH → 2Mn2+ + 8H2O + 5CO2
Bài 4: Nước oxi già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2).
a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử.
Giải nhanh:
a) Số oxi hóa của O là -1, H là +1
b) Nguyên tử O vì số oxi hóa của O là -1 trong H2O2, trong các hợp chất khác số oxi hóa của O thường là -2.
Quá trình khử: O-1 + 1e → O-2
Giải nhanh:
- PTHH: C2H5OH + 3O2 ![]() 2CO2 + 3H2O
2CO2 + 3H2O
- Là phản ứng oxi hóa – khử, thuộc loại phản ứng cung cấp năng lượng.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận