Dễ hiểu giải Hóa học 10 cánh diều bài 9: Quy tắc octet
Giải dễ hiểu bài 9: Quy tắc octet. Trình bày rất dễ hiểu, nên tiếp thu Hóa học 10 Cánh diều dễ dàng. Học sinh nắm được kiến thức và biết suy rộng ra các bài tương tự. Thêm 1 dạng giải mới để mở rộng tư duy. Danh mục các bài giải trình bày phía dưới
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 9. QUY TẮC OCTET
MỞ ĐẦU
Quan sát hiện tượng tự nhiên sau:
Viên bi rơi từ trên cao (vị trí có năng lượng cao hơn) xuống dưới đất (vị trí có năng lượng thấp hơn) mà không tự lăn theo chiều ngược lại.
Hãy cho biết quá trình trên diễn ra theo xu hướng tạo nên hệ bền hơn (năng lượng thấp hơn) hay kém bền hơn (năng lượng cao hơn).
Giải nhanh:
Diễn ra theo xu hướng tạo nên hệ bền hơn.
I. QUY TẮC OCTET
Câu hỏi 1: Cho nguyên tử các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10), Ar (Z = 18). Những nguyên tử nào trong các nguyên tử trên có lớp electron ngoài cùng bền vững?
Giải nhanh:
Nguyên tử Ne và Ar có lớp electron ngoài cùng bền vững.
II. VẬN DỤNG QUY TẮC OCTET TRONG QUÁ TRÌNH HÌNH THÀNH LIÊN KẾT HÓA HỌC CỦA CÁC NGUYÊN TỐ NHÓM A
Câu hỏi 2: Oxygen có Z = 8, cho biết xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học. Hãy vẽ sơ đồ minh họa quá trình đó.
Giải nhanh:
- Xu hướng cơ bản của nguyên tử O khi hình thành liên kết hóa học là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ne.
- Sơ đồ:
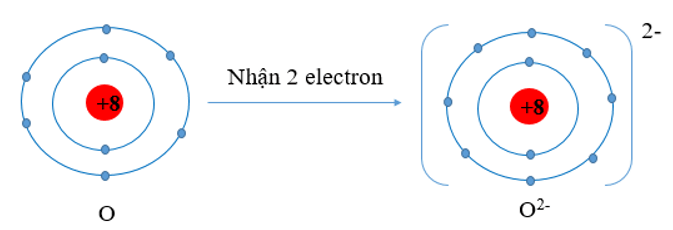
Luyện tập 1:Tính phi kim được đặc trưng bằng khả năng nhận electron. Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhường hay nhận bao nhiêu electron?
Giải nhanh:
- Nguyên tử O có xu hướng nhận thêm 2 electron.
- Nguyên tử F có xu hướng nhận thêm 1 electron.
Luyện tập 2: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ sơ đồ (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion.
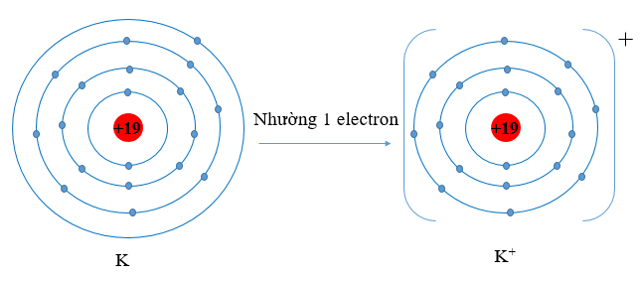
a) K (Z = 19) và O (Z = 8)
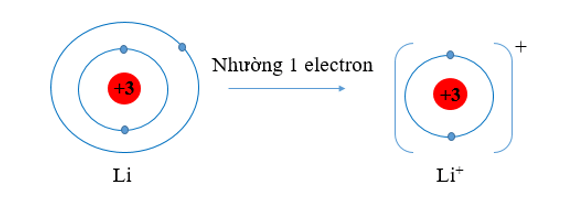
b) Li (Z = 3) và F (Z = 9)
c) Mg (Z = 12) và P (Z = 15)
Giải nhanh:
a) - Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
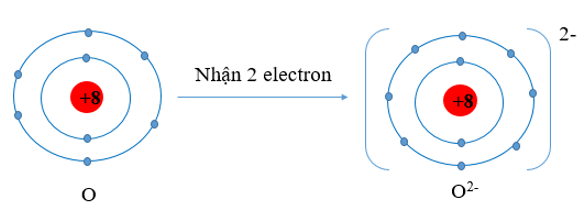
- Nguyên tử O có xu hướng nhận thêm 2 electron để trở thành ion mang điện tích âm, kí hiệu là O2-
b) - Nguyên tử Li có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là Li+.
- Nguyên tử F có xu hướng nhận thêm 1 electron để trở thành ion mang điện tích âm, kí hiệu là F-.
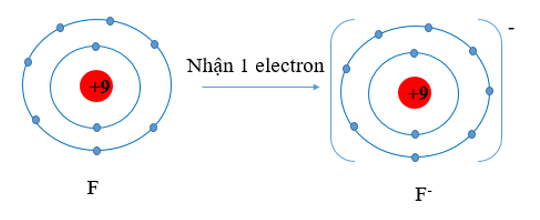
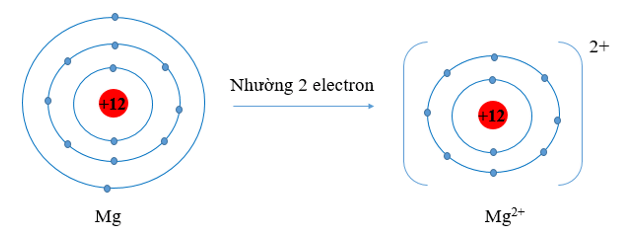
c) - Nguyên tử Mg có xu hướng nhường đi 2 electron để trở thành ion mang điện tích dương, kí hiệu là Mg2+.
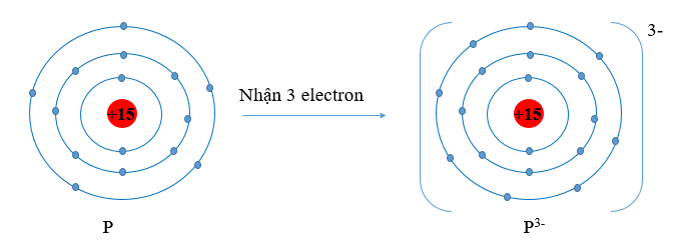
- Nguyên tử P có xu hướng nhận thêm 3 electron để trở thành ion mang điện tích âm, kí hiệu là P3-.
Luyện tập 3: Vì sao nguyên tử của các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron ở lớp ngoài cùng (thỏa mãn quy tắc 8 electron khi tham gia liên kết)?
Giải nhanh:
Do các nguyên tố thuộc này có 2 lớp electron mà lớp thứ 2 có 4 AO, mà mỗi AO có tối đa 2 electron.
BÀI TẬP
Bài 1: Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron.
B. Nhận 5 electron, nhường 5 electron.
C. Nhường 3 electron, nhận 3 electron.
D. Nhường 5 electron, nhận 5 electron.
Giải nhanh:
Chọn A.
Bài 2: Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Boron
B. Potassium
C. Helium
D. Fluorine.
Giải nhanh:
Chọn B.
Bài 3: Xu hướng tạo lớp vỏ bền vững hơn của các nguyên tử thể hiện như thế nào trong các trường hợp sau đây?
a) Kim loại điển hình tác dụng với phi kim điển hình.
b) Phi kim tác dụng với phi kim.
Giải nhanh:
a) Các nguyên tử kim loại sẽ có xu hướng nhường electron còn các nguyên tử phi kim sẽ có xu hướng nhận electron để hình thành liên kết hóa học.
b) Hai nguyên tử phi kim sẽ góp chung electron. Sau khi hình thành liên kết mỗi nguyên tử phi kim sẽ có 8 electron lớp ngoài cùng.
Bài 4: Ở dạng đơn chất, sodium (Na) và chlorine (Cl) rất dễ tham gia các phản ứng hóa học, nhưng muối ăn được tạo nên từ hai nguyên tố này lại không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron. Giải thích.
Giải nhanh:
- Nguyên tử Na dễ dàng nhường đi 1 electron để tạo thành ion Na+
- Nguyên tử Cl dễ dàng nhận thêm 1 electron để tạo thành ion Cl-.
- Hai ion Na+ và Cl- hút nhau tạo thành hợp chất ion NaCl. Mà cả hai ion đều đã có cấu hình bền vững của khí hiếm nên không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron.
Bài 5: Cho một số hydrocarbon sau: H-C≡C-H, H2C=CH2 và H3C-CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
Biết rằng mỗi gạch (-) trong các công thức trên biểu diễn hai electron hóa trị chung.
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Giải nhanh:
a) Công thức: H-C≡C-H, H2C=CH2 và H3C-CH3
b) Giá trị x lớn nhất có thể là 8.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận