Lý thuyết trọng tâm hóa học 10 cánh diều bài 9: Quy tắc octet
Tổng hợp kiến thức trọng tâm hóa học 10 cánh diều bài 9: Quy tắc octet. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. QUY TẮC OCTET
- (1) Quy tắc octet là trong các phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
Lewis là người đầu tiên đưa ra quy tắc này. Quy tắc này nói về xu hướng các nguyên tử trở nên bền vững hơn trong phản ứng hóa học.
- (2) Đặc điểm của quy tắc octet là các nguyên tử khí hiếm bền vững hơn rất nhiều so với các nguyên tử khác cùng chu kì nên rất khó tham gia phản ứng hóa học. Điều này do chúng có lớp electron ngoài cùng đã bão hòa với 8 electron ( ngoại lệ là He với electron ngoài cùng bão hòa 2 electron)
- (3) Xu hướng chung của các nguyên tử liên kết với nhau là tạo ra một lớp electron ngoài cùng như của khí hiếm để mỗi nguyên tử đó trở nên bền vững hơn. Những liên kết hóa học em biết là: liên kết ion, liên kết cộng hóa trị.
- (4) Nguyên tố Ne và Ar có lớp electron ngoài cùng bền vững.
II. VẬN DỤNG QUY TẮC OCTET TRONG QUÁ TRÌNH HÌNH THÀNH LIÊN KẾT HÓA HỌC CỦA CÁC NGUYÊN TỐ NHÓM A.
Nhiệm vụ 1:
1. Nguyên tử chlorine có 7 electron ở lớp vơ ngoài cùng, vì vậy khi hình thành liên kết hóa học, chlorine nhận thêm 1 electron để đạt lớp vỏ 8 electron ở lớp ngoài cùng như của khí hiếm Ar.
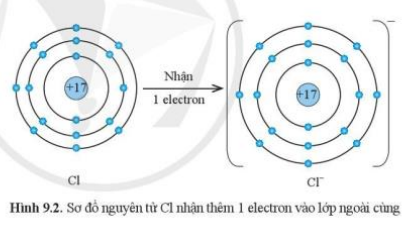
2. Trả lời luyện tập 2 sgk:
O và F đều có tính phi kim ⇒ Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhận electron.
Trong đó O (Z = 8) có cấu hình electron là 1s$^{2}$2s$^{2}$2p$^{4}$ => Nguyên tử O sẽ nhận thêm 2 electron để được lớp vỏ có 8 electron lớp ngoài cùng bền vững.
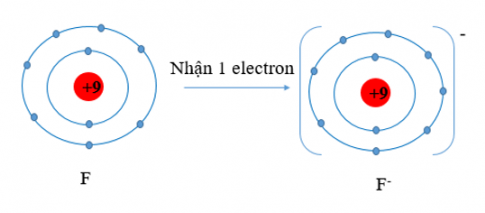
F (Z = 9) có cấu hình electron là 1s$^{2}$2s2$^{2}$p$^{5}$ => Nguyên tử F sẽ nhận thêm 1 electron để được lớp vỏ có 8 electron lớp ngoài cùng bền vững.
3. Các phi kim 5, 6 hoặc 7 electeon ở lớp ngoài cùng có xu hướng nhận thêm lần lượt 3, 2, 1 electron để đạt cấu hình bền vững.
Nhiệm vụ 2:
1. Nguyên tử Na có 1 electron ở lớp vỏ ngoài cùng, vậy nên khi hình thành liên kết hóa học Na thường có xu hướng nhường đi 1 electron để đạt cấu hình lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ne.

2. Trả lời luyện tập 2:
a) K (Z = 19), K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K$^{+}$.

O (Z = 8), O có 6 electron lớp vỏ ngoài cùng nên nguyên tử O có xu hướng nhận thêm 2 electron để trở thành ion mang điện tích âm, kí hiệu là O$^{2-}$

b) Li (Z = 3), Li có 1 electron lớp vỏ ngoài cùng. Nguyên tử Li có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là Li$^{+}$.

F (Z = 9), F có 7 electron lớp vỏ ngoài cùng. Nguyên tử F có xu hướng nhận thêm 1 electron để trở thành ion mang điện tích âm, kí hiệu là F$^{-}$.
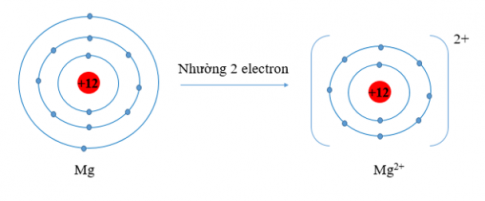
c) Mg (Z = 12), Mg có 2 electron lớp vỏ ngoài cùng. Nguyên tử Mg có xu hướng nhường đi 2 electron để trở thành ion mang điện tích dương, kí hiệu là Mg$^{2+}$.
P (Z = 15). P có 5 electron lớp vỏ ngoài cùng. Nguyên tử P có xu hướng nhận thêm 3 electron để trở thành ion mang điện tích âm, kí hiệu là P$^{3-}$.

3. Các kim loại có 1, 2 và 3 electron lớp ngoài cùng có xu hướng nhương đi lần lượt 1, 2, 3 electron tương ứng để tạo thành ion dương có cấu hình bền vững.
Nhiệm vụ 3:
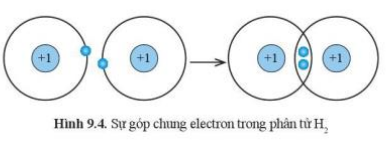
1. Phân tử H$_{2}$ hình thành từ 2 nguyên tử H (Hình 9.4). Mỗi nguyên tử H góp chung 1 electron tạo cặp electron chung. Sau khi hình thành liên kết, mỗi nguyên tử H đều có 1 đôi electron, giống lớp vỏ bền vững của khí hiếm He.
2. Nguyên tử N có 5 electron ở lớp vỏ ngoài cùng. Để hình thành liên kết hóa học, 2 nguyên tử N, mỗi nguyên tử N sẽ góp chung 3 electron để tạo 3 cặp electron chung. Sau khi hình thành liên kết, mỗi nguyên tử N có 8 electron ở lớp vỏ ngoài cùng, giống với cấu hình của nguyên tố Ne.
3. Trả lời luyện tập 3 sgk:
Các nguyên tố thuộc chu kì 2, có 2 lớp electron. Lại có, lớp thứ 2 có 4 AO, mà mỗi AO có tối đa 2 electron nên các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron.
Nhiệm vụ 4:
1. Sự hình thành phân tử NaCl:
- Nguyên tử Na có 1 electron lớp ngoài cùng, nguyên tử Cl có 7 electron ở lớp vỏ ngoài cùng. Khi hình thành liên kết hoa học, Na sẽ nhường 1 electron của mình cho nguyên tử Cl.
- Lúc này Na sẽ trở thành ion Na+ có cấu hình giống Ne và Cl trở thành Cl- có cấu hình giống Ar. Na+ và Cl- hình thành liên kết ion nhờ lực hút tĩnh điện của 2 điện tích trái dấu.
- Sự hình thành phân tử HCl
- Nguyên tử H có 1 electron ở lớp vỏ ngoài cùng, nguyên tử Cl có 7 electron ở lớp vỏ ngoài cùng. Khi hình thành liên kết hóa học, mỗi nguyên tử có xu hướng góp chung 1 electron tạo thành cặp electron dùng chung. Sau khi hình thành liên kết, nguyên tử H có cấu hình giống với He, nguyên tử Cl có cấu hình giống với Ar. Liên kết trong phân tử HCl gọi lag liên kết cộng hóa trị.
2. Trả lời bài tập 3 sgk:
a) Trong trường hợp kim loại điển hình tác dụng với phi kim điển hình, các nguyên tử kim loại sẽ có xu hướng nhường electron còn các nguyên tử phi kim sẽ có xu hướng nhận electron để hình thành liên kết hóa học.
b) Trong trường hợp phi kim tác dụng với phi kim, hai nguyên tử phi kim sẽ góp chung electron. Sau khi hình thành liên kết mỗi nguyên tử phi kim sẽ có 8 electron lớp ngoài cùng, giống lớp vỏ bền vững của khí hiếm.
=> Kết luận: Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình nềm vững như khí hiếm với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium)
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận