Lý thuyết trọng tâm khoa học tự nhiên 8 cánh diều bài 3: Định luật bảo toàn khối lượng. Phương trình hoá học
Tổng hợp kiến thức trọng tâm khoa học tự nhiên 8 cánh diều bài 3: Định luật bảo toàn khối lượng. Phương trình hoá học. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. Định luật bảo toàn khối lượng
Thí nghiệm 1
1. Hiện tượng thí nghiệm 1:
- Ở bước 1, chưa có hiện tượng gì, ghi chỉ số khối lượng cụ thể $m_A$
- Ở bước 2, xuất hiện kết tủa màu trắng (chứng tỏ có phản ứng hóa học xảy ra), ghi chỉ số khối lượng cụ thể $m_B$.
2. So sánh $m_A$ với $m_B$
Nhận xét: $m_A = m_B$ (tổng khối lượng của các chất tham gia phản ứng ($m_A$ bằng tổng khối lượng các chất sản phẩm ($m_B$)
Thí nghiệm 2
1. Hiện tượng thí nghiệm 2:
- Ở bước 1, chưa có hiện tượng gì, ghi chỉ số khối lượng cụ thể $m_A$
- Ở bước 2, có bọt khí bay lên (chứng tỏ có phản ứng hóa học xảy ra), ghi chỉ số khối lượng cụ thể $m_B$.
2. So sánh $m_A$ với $m_B$
Nhận xét: $m_B < m_A$ (do khí bay lên)
Kết luận:
Tổng khối lượng của các chất phản ứng = Tổng khối lượng của các chất sản phẩm
Định luật bảo toàn khối lượng:
Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất phản ứng.
II. Áp dụng định luật bảo toàn khối lượng
1. Phương trình bảo toàn khối lượng
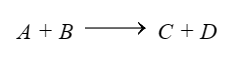
Phương trình bảo toàn khối lượng:
$m_A + m_B = m_C + m_D$
Trong đó: $m_A, m_B, m_C, m_D$ lần lượt là khối lượng của các chất phản ứng và sản phẩm.
2. Áp dụng định luật bảo toàn khối lượng
1. $Fe + 2HCl → FeCl_2 + H_2$
Áp dụng định luật bảo toàn khối lượng ta có:
$m_{Fe} + m_{HCl} = m_{FeCl_2} + m_{H_2}$
=> $m_{H_2} = m_{Fe} + m_{HCl} - m_{FeCl_2} = 5,6 + 7,3 – 12,7 = 0,2 (g)$
2. $C + O_2 →CO_2$
Áp dụng định luật bảo toàn khối lượng ta có:
$m_C + m_{O_2}= m_{CO_2}$
=> $m_{O_2} = m_{CO_2} – m_C = 44 – 12 = 32 (g)$
III. Phương trình hóa học
1. Phương trình hóa học là gì?
1. Phương trình hóa học là cách thức biểu diễn phản ứng hóa học bằng công thức hóa học của các chất phản ứng và các chất sản phẩm.
2. Các bước lập phương trình hóa học
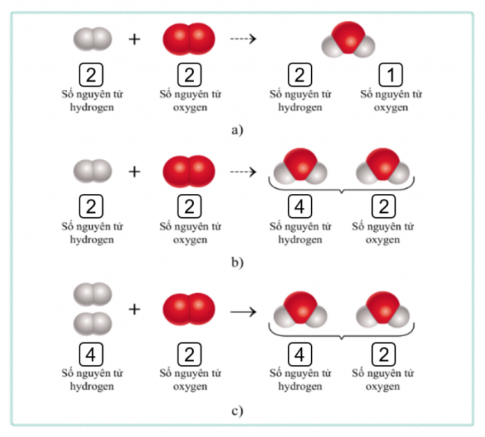
2. Phản ứng hóa học diễn ra khi cho khí hydrogen tác dụng với khí oxygen tạo thành nước được biểu diễn bằng sơ đồ chữ:
Hydrogen + Oxygen → Nước
Thay thế tên các chất bằng công thức hóa học, tìm hệ số thích hợp sao cho số nguyên tử mỗi nguyên tố ở hai vế của phương trình đều bằng nhau, được phương trình hóa học của phản ứng:
$2H_2 + O_2 →2H_2O$
3. Trong phản ứng hóa học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của các nguyên tố đó trong các chất sản phẩm
4.
2. Các bước lập phương trình hóa học
1. Các bước lập phương trình hóa học:
- Bước 1: Viết sơ đồ của phản ứng
- Bước 2: So sánh số nguyên tử của mỗi nguyên tố có trong phân tử các chất phản ứng và các chất sản phẩm
- Bước 3: Cân bằng số nguyên tử của mỗi nguyên tố
- Bước 4: Kiểm tra và viết phương trình hóa học
2. Nếu trong các chất phản ứng và các chất sản phẩm có nhóm nguyên tử không thay đổi trước và sau phản ứng thì coi cả nhóm nguyên tử đó như là một đơn vị để cân bằng
3. a)
Bước 1: Viết sơ đồ của phản ứng
$Fe + O_2 → Fe_3O_4$
Bước 2: So sánh số nguyên tử của mỗi nguyên tố/chất trước và sau phản ứng
$Fe + O_2 → Fe_3O_4$ | ||||
Số nguyên tử | 1 | 2 | 3 | 4 |
Bước 3: Cân bằng số nguyên tử của mỗi nguyên tố
$3Fe + 2O_2 → Fe_3O_4$ | ||||
Số nguyên tử | 3 | 4 | 3 | 4 |
Bước 4: Kiểm tra và viết phương trình hóa học
$3Fe + 2O_2 ⟶ Fe_3O_4$
b) Bước 1: Viết sơ đồ của phản ứng
$Al_2(SO_4)_3 + NaOH → Al(OH)_3 + Na_2SO_4$
Bước 2: So sánh số nguyên tử của mỗi nguyên tố/chất trước và sau phản ứng
$Al_2(SO_4)_3 + NaOH ⇢ Al(OH)_3 + Na_2SO_4$ | ||||||||
Số/nhóm nguyên tử | 2 | 3 | 1 | 1 | 1 | 3 | 2 | 1 |
Bước 3: Cân bằng số/nhóm nguyên tử
$Al_2(SO_4)_3 + 6NaOH ⇢ 2Al(OH)_3 + 3Na_2SO_4$ | ||||||||
Số/nhóm nguyên tử | 2 | 3 | 6 | 6 | 2 | 6 | 6 | 1 |
Bước 4: Kiểm tra và viết phương trình hóa học
$Al_2(SO_4)_3 + 6NaOH ⇢ 2Al(OH)_3 + 3Na_2SO_4 $
3. Ý nghĩa của phương trình hóa học
1) Phương trình hóa học cho biết:
- Các chất phản ứng và các chất sản phẩm
- Tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng. Tỉ lệ này bằng đúng tỉ lệ hệ số của mỗi chất trong phương trình hóa học
2) $Na_2CO_3 + Ba(OH)_2 → BaCO_3 + 2NaOH$
a) 1 phân tử $Na_2CO_3$ phản ứng với 1 phân tử $Ba(OH)_2$ tạo ra 1 phân tử $BaCO_3$ và 2 phân tử NaOH
b) Tỉ lệ hệ của các chất trong phương trình hóa học = 1 : 1 : 1 : 2
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận