Đáp án Hóa học 10 Kết nối bài 3 Cấu trúc lớp vỏ electron nguyên tử
Đáp án bài 3 Cấu trúc lớp vỏ electron nguyên tử. Bài giải được trình bày ngắn gọn, chính xác giúp các em học Hóa học 10 Kết nối tri thức dễ dàng. Từ đó, hiểu bài và vận dụng vào các bài tập khác. Đáp án chuẩn chỉnh, rõ ý, dễ tiếp thu. Kéo xuống dưới để xem chi tiết
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 3. CẤU TRÚC LỚP VỎ ELECTRON NGUYÊN TỬ
I. CHUYỂN ĐỘNG CỦA ELECTRON TRONG NGUYÊN TỬ
Câu hỏi 1: Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử như thế nào?
Đáp án chuẩn:
Chuyển động rất nhanh, không theo quỹ đạo xác định.
Câu hỏi 2: Orbital s có dạng
A. Hình tròn. B. Hình số tám nổi. C. Hình cầu. D. Hình bầu dục.
Đáp án chuẩn:
C.
Câu hỏi 3: Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian.
Đáp án chuẩn:
Hình số 8 nổi và 3 định hướng: orbital px, py, pz lần lượt là định hướng theo trục x, y, z.
II. LỚP VÀ PHÂN LỚP ELECTRON
Câu hỏi 4: Hãy cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p. b) Phân lớp d.
Đáp án chuẩn:
a) 6.
b) 10.
Câu hỏi 5: Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là:
A. 2 và 8 B. 8 và 10 C. 8 và 18 D. 18 và 32.
Đáp án chuẩn:
C.
III. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
Câu hỏi 6: Cấu hình electron của nguyên tử có Z = 16 là:
A. 1s22s22p63s23p3. B. 1s22s22p63s23p5.
C. 1s22s22p63s23p4. C. 1s22s22p53s23p5.
Đáp án chuẩn:
C.
Câu hỏi 7: Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital.
Đáp án chuẩn:
Z = 8:
Z = 11: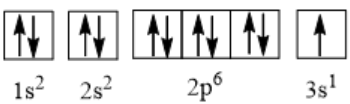
Câu hỏi 8: Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, …. Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Đáp án chuẩn:
- Thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng.
- Điền electron vào các phân lớp theo nguyên lí vững bền: 1s22s22p63s23p2.
- Biểu diễn theo ô orbital:
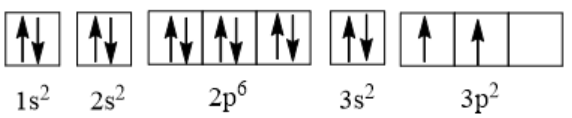
- Nguyên lí Pauli: Các ô orbital 1s, 2s và 2p, 3s có đủ electron được biểu diễn bằng hai mũi tên ngược chiều nhau ở mỗi ô.
- Quy tắc Hund: 2 electron còn lại được sắp xếp vào 2 ô orbital 3p bằng 2 mũi tên đi lên để số electron độc thân là tối đa.
Câu hỏi 9: Chlorine (Z=17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kim.
Đáp án chuẩn:
1s22s22p63s23p5 do có 5 electron ở lớp ngoài cùng.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận