5 phút giải Khoa học tự nhiên 7 kết nối tri thức trang 36
5 phút giải Khoa học tự nhiên 7 kết nối tri thức trang 36. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 6. GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Câu hỏi: Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
I. CẤU TRÚC ELECTRON BỀN VỮNG CỦA KHÍ HIẾM
Câu hỏi: Quan sát hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar

II. LIÊN KẾT ION
Câu 1: Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-

Câu 2: Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:

Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron.
III. LIÊN KẾT CỘNG HÓA TRỊ
1. Liên kết cộng hóa trị trong phân tử đơn chất
Câu 1: Quan sát Hình 6.4 và Hình 6.5, cho biết số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị

Câu 2: Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
2. Liên kết cộng hóa trị trong phân tử hợp chất
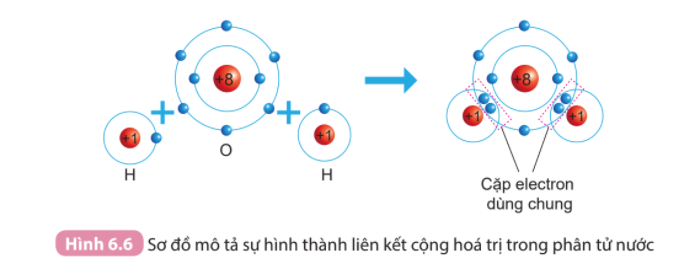
Câu 1: Quan sát Hình 6.6 và cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen giống với lớp vỏ của nguyên tử khí hiếm nào?
Câu 2: Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia (gồm một nguyên tử N liên kết với ba nguyên tử H)
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
Câu hỏi:
Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron.
I. CẤU TRÚC ELECTRON BỀN VỮNG CỦA KHÍ HIẾM
Câu hỏi:
He < Ne và Ar, Ne = Ar.
II. LIÊN KẾT ION
Câu 1:
Na > ion Na+
Cl < ion Cl-
Câu 2:
Nhường 2 electron.
III. LIÊN KẾT CỘNG HÓA TRỊ
1. Liên kết cộng hóa trị trong phân tử đơn chất
Câu 1:
- Trước: H là 1 và sau: H là 2.
- Trước: O là 6 và sau: O là 8.
Câu 2:
- Nguyên tử Cl có 7e ở lớp ngoài cùng → hai phân tử Cl liên kết với nhau bằng cách góp chung 1e tạo thành 1 cặp e dùng chung.
- Nguyên tử N có 5e ở lớp ngoài cùng → hai phân tử N liên kết với nhau bằng cách góp chung 3e tạo thành 3 cặp e dùng chung.
2. Liên kết cộng hóa trị trong phân tử hợp chất
Câu 1:
Ne.
Câu 2:
- Carbon dioxide, hai O liên kết với một C bằng cách góp chung hai electron tạo thành hai cặp electron dùng chung.
- Ammonia, ba H liên kết với một N bằng cách góp chung một electron tạo thành cặp electron dùng chung.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Khoa học tự nhiên 7 kết nối tri thức, giải Khoa học tự nhiên 7 kết nối tri thức trang 36, giải Khoa học tự nhiên 7 KNTT trang 36

Bình luận