5 phút giải Hóa học 10 Chân trời sáng tạo trang 72
5 phút giải Hóa học 10 Chân trời sáng tạo trang 72. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 12: PHẢN ỨNG OXI HOÁ – KHỬ VÀ ỨNG DỤNG TRONG CUỘC SỐNG
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Đom đóm có thể phát sáng ra ánh sáng đặc biệt, không toả nhiệt như ánh sáng nhân tạo. Cấu tạo bên trong lớp da bọng của đom đóm là dãy các tế bào phát quang có chứa leciferin. Luciferin tác dụng với oxygen, cùng xúc tác enzyme, để tạo ra ánh sáng. Đây là phản ứng oix hoá – khử.
Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hoá – khử gây ra. Phản ứng oxi hoá – khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào?
1. SỐ OXI HOÁ
Thảo luận 1: Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen.
Thảo luận 2: Quan sát Hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chloride (HCl). Nếu cặp electron chung trong hợp chất cộng hoá trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl.
Thảo luận 3: Nêu điểm khác nhau giữa kí hiệu số oxi hoá và kí hiện điện tích của ion M trong hình sau:

Thảo luận 4: Dự đoán số oxi hoá của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích.
Luyện tập: Hãy xác định số oxi hoá của các nguyên tử trong các đơn chất, hợp chất và ion sau: Zn, H2, Cl-, O2-, S2-, ![]() , Na2S2O3, KNO3.
, Na2S2O3, KNO3.
Luyện tập: Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép với công thức hoá học là Fe3O4.
Hãy xác định số oxi hoá của nguyên tử Fe trong hợp chất trên.
2. PHẢN ỨNG OXI HOÁ – KHỬ
Thảo luận 5: Hãy nhận xét và giải thích sự thay đổi số oxi hoá của các nguyên tử trong chất oxi hoá và chất khử trước và sau phản ứng.
Luyện tập: Cho phương trình hoá học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3![]() 2KCl + 3O2↑ (2)
2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hoá – khử? Vì sao? Hãy xác định quá trình oxi hoá và quá trình khử của các phản ứng đó.
Thảo luận 6: Làm thế nào để biết một phản ứng là phản ứng oxi hoá – khử?
Luyện tập: Hãy nêu 3 ví dụ về phản ứng có sự thay đổi số oxi hoá của nguyên tử và 3 ví dụ về phản ứng không có sự thay đổi số oxi hoá của nguyên tử.
3. LẬP PHƯƠNG TRÌNH HOÁ HỌC CỦA PHẢN ỨNG OXI HOÁ – KHỬ
Luyện tập: Lập phương trình hoá học của các phản ứng oxi hoá – khử sau, xác định vai trò của các chất tham gia phản ứng.
KMnO4 + HCl → KCl + MnCl2 + Cl2↑ + H2O (1)
NH3 + Br2 → N2 + HBr (2)
NH3 + CuO ![]() Cu + N2 + H2O (3)
Cu + N2 + H2O (3)
FeS2 + O2 ![]() Fe2O3 + SO2 (4)
Fe2O3 + SO2 (4)
KClO3![]() KCl + O2↑ (5)
KCl + O2↑ (5)
4. Ý NGHĨA CỦA PHẢN ỨNG OXI HOÁ – KHỬ
Thảo luận 7: Lập phương trình hoá hoc của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng.
Thảo luận 8: Quan sát Hình 12.7 và đọc thông tin, hãy lập phương trình hoá học của phản ứng quang hợp ở cây xanh. Quá trình quang hợp của thực vật có vai trò quan trọng như thế nào đối với cuộc sống?
Thảo luận 9: Từ thông tin về “Luyện kim”, viết phản ứng của khí carbon monoxide khử iron (II) oxide ở nhiệt độ cao. Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron, xác định vai trò của các chất trong phản ứng.
Thảo luận 10: Đọc thông tin về “Điện hoá” để biết được phản ứng oxi hoá – khử gắn liền với cuộc sống. Lập phương trình hoá học của phản ứng sinh ra dòng điện trong pin khi zinc phản ứng với manganese dioxide.
Vận dụng: Hãy nêu thêm một số phản ứng oxi hoá – khử quan trọng gắn với đời sống hằng ngày.
BÀI TẬP
Bài 1: Tính số oxi hoá của nguyên tử có đánh dấu * trong các chất và ion dưới đây:
![]()
Bài 2: Lập phương trình hoá học của các phản ứng sau bằng pương pháp thăng bằng electron, nêu rõ chất oxi hoám chất khử trong mỗi trường hợp.
a) HCl + MnO2 ![]() MnCl2 + Cl2↑ + H2O
MnCl2 + Cl2↑ + H2O
b) KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
c) Fe3O4 + HNO3 → Fe(NO3)3 + NO↑ + H2O
d) H2C2O2 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
Bài 3: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hoá – khử gắn liền với cuộc sống hằng ngày và lập phương trình hoá học của các phản ứng đó bằng phương pháp thăng bằng electron.
Bài 4: Viết phương trình hoá học của phản ứng điều chế muối xinc chloride (ZnCl2) bằng một phản ứng oxi hoá – khử và một phản ứng không phải là phản ứng oxi hoá – khử.
Bài 5: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200 oC, ammonium perchlorate nổ theo phản ứng sau:
NH4ClO4 ![]() N2↑ + Cl2↑ + O2↑ + H2O↑
N2↑ + Cl2↑ + O2↑ + H2O↑
Lập phương trình hoá học của phản ứng bằng phương pháp thăng bằng electron.
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
- PƯHH có sự chuyển dịch electron giữa các chất phản ứng.
- Vai trò:
+ Sự cháy của than củi; sự cháy của xăng, dầu trong các động cơ đốt trong; các phản ứng xảy ra trong pin…
+ Sản xuất công nghiệp nặng; sản xuất hóa chất cơ bản; sản xuất phân bón;…
1. SỐ OXI HOÁ
Thảo luận 1:
Mg → Mg2+ + 2e
O2 + 4e → 2O2-
Thảo luận 2:
Cl: 1- và H: 1+.
Thảo luận 3:
Số OXH: dấu trước số, điện tích: số trước dấu.
Thảo luận 4:
+1, +2, +3 vì số oxi hoá trùng với số thứ nhóm.
Luyện tập:
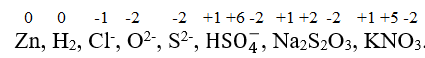
Luyện tập:
+8/3.
2. PHẢN ỨNG OXI HOÁ – KHỬ
Thảo luận 5:
Zn: từ 0 đến +2. H: +1 về 0.
Luyện tập:
PƯ(1) và (2) vì có sự thay đổi số oxi hoá.
(1): S-2 → S + 2e (quá trình OXH); Br2 + 2e → 2Br-1 (quá trình khử)
(2): 2O-2 → O2 + 4e (quá trình OXH); Cl+5 + 6e → Cl-1 (quá trình khử).
Thảo luận 6:
- Sự thay đổi số OXH.
- Xảy ra đồng thời quá trình OXH và quá trình khử.
Luyện tập:
- Có thay đổi:

- Không thay đổi:
NaOH + HCl → NaCl + H2O
CaCO3 + H2SO4 → CaSO4 + CO2+ H2O
2Fe(OH)3 → Fe2O3 + 3H2O
3. LẬP PHƯƠNG TRÌNH HOÁ HỌC CỦA PHẢN ỨNG OXI HOÁ – KHỬ
Luyện tập:
(1): chất OXH: KMnO4, chất khử: HCl.
5x |2Cl-1 → Cl2 + 2e
2x |Mn+7 + 5e → Mn+2
PTHH: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(2) chất OXH Br2, chất khử NH3.
2N-3 → N2 + 6e
3x |Br2 + 2e → 2Br-1
PTHH: 2NH3 + 3Br2 → N2 + 6HBr
(3) chất OXH CuO, chất khử NH3.
2N-3 → N2 + 6e
3x |Cu+2 + 2e → Cu
PTHH: 2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
(4) chất OXH FeS2, chất khử O2.
4x |Fe+2 → Fe+3 + e
4x |2S-1 → 2S+4 + 10e
11x |O2 + 4e → 2O-2
PTHH: 4FeS2 + 11O2![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
(5) KClO3 vừa là chất khử, vừa là chất OXH.
3x |2O-2 → O2 + 4e
2x |Cl+5 + 6e → Cl-1
PTHH: 2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
4. Ý NGHĨA CỦA PHẢN ỨNG OXI HOÁ – KHỬ
Thảo luận 7:
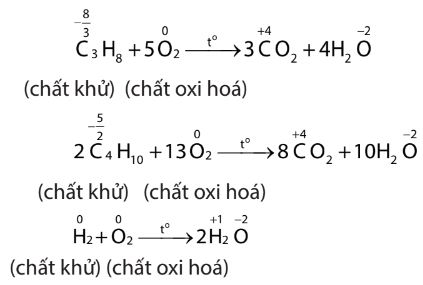
Thảo luận 8:
PTHH: 6CO2 + 6H2O ![]() C6H12O6 + 6O2
C6H12O6 + 6O2
Tổng hợp carbohydrate, tích luỹ năng lượng cho thực vật, điều hoà không khí…
Thảo luận 9:
Chất khử CO, chất OXH Fe2O3.
2Fe+3 + 6e → Fe
3x| C+2 → C+4 + 2e
PTHH: 3CO + Fe2O3 ![]() 3CO2 + 2Fe
3CO2 + 2Fe
Thảo luận 10:
Chất khử Zn, chất OXH MnO2.
2Mn+4 + 2e → 2Mn+3
Zn → Zn+2 + 2e
PTHH: Zn + 2MnO2 → ZnO + Mn2O3 + năng lượng
Vận dụng:
Phản ứng gỉ sắt, phản ứng thuỷ phân, cao su dùng lâu bị cứng…
BÀI TẬP
Bài 1:
a) +6, +7, +7, -3.
b) +3, +5, +5, +6.
Bài 2:
a) 4HCl + MnO2 ![]() MnCl2 + Cl2↑ + H2O
MnCl2 + Cl2↑ + H2O
HCl: chất OXH, MnO2: chất khử
b) 2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
KMnO4: chất OXH, KNO2: chất khử
c) 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O
Fe3O4: chất khử, HNO3: chất OXH
d) 5H2C2O2 + 6KMnO4 + 9H2SO4 → 10CO2↑ + 6MnSO4 + 3K2SO4 + 14H2O
H2C2O2: chất khử, KMnO4: chất OXH
Bài 3:
Đốt than: C + O2 ![]() CO2
CO2
Lên men glucose: C6H12O6 ![]() 2C2H5OH + 2CO2
2C2H5OH + 2CO2
Bài 4:
Zn + 2HCl → ZnCl2 + H2; ZnO + 2HCl → ZnCl2 + H2O
Bài 5:

Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 10 Chân trời sáng tạo, giải Hóa học 10 Chân trời sáng tạo trang 72, giải Hóa học 10 CTST trang 72

Bình luận