5 phút giải Hóa học 10 Chân trời sáng tạo trang 43
5 phút giải Hóa học 10 Chân trời sáng tạo trang 43. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 6. XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH CHẤT CỦA NGUYÊN TỬ CÁC NGUYÊN TỐ,THÀNH PHẦN VÀ MỘT SỐ TÍNH CHẤT CỦA HỢP CHẤT TRONG MỘT CHU KÌ VÀ NHÓM
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Kim loại kiềm là các kim loại nhóm IA, bao gồm: lithium (Li), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr). Chúng phản ứng được với nước và giải phóng khí hydrogen. Vậy khả năng phản ứng với nước của các kim loại trên có giống nhau hay không? Dựa vào bảng tuần hoàn các nguyên tố hóa học, chúng ta có thể giải thích được xu hướng biến đổi tính chất hóa học cơ bản của nguyên tử các nguyên tố không?
1. BÁN KÍNH NGUYÊN TỬ
Thảo luận 1: Quan sát hình 6.1, cho biết bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A biến đổi như thế nào?
Thảo luận 2: Xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A do yếu tố nào gây ra?
Luyện tập: Dựa vào xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử: Li, N, O, Na, K.
2. ĐỘ ÂM ĐIỆN
Thảo luận 3: Từ số liệu trong bảng 6.1, nhận xét sự biến đổi giá trị độ âm điện của nguyên tử các nguyên tố trong một nhóm và trong một chu kì. Giải thích.
Thảo luận 4: Hãy cho biết vì sao trong bảng 6.1, giá trị độ âm điện của nguyên tử các nguyên tố nhóm VIIIA còn để trống.
Luyện tập: Dựa vào xu hướng biến đổi độ âm điện của nguyên tử các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần độ âm điện của nguyên tử: Na, K, Mg, Al.
3. TÍNH KIM LOẠI, TÍNH PHI KIM
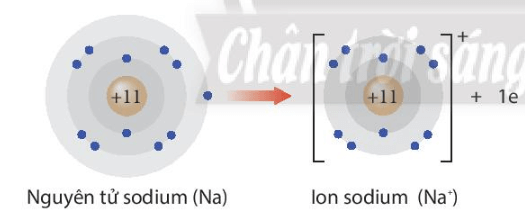
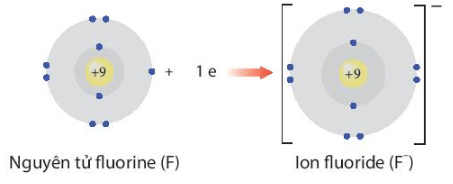
Thảo luận 5: Giải thích sự hình thành ion Na+ và ion F-.
Thảo luận 6: Khả năng nhường hoặc nhận electron hóa trị của nguyên tử các nguyên tố nhóm A thay đổi như thế nào khi:
a) đi từ đầu chu kì đến cuối chu kì?
b) đi từ đầu nhóm đến cuối nhóm?.
Luyện tập: Dựa vào xu hướng biến đổi tính kim loại- phi kim của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các nguyên tố sau đây theo chiều giảm dần tính kim loại: sodium, magnesium và potassium.
4. TÍNH ACID – BASE CỦA OXIDE VÀ HYDROXIDE
Thảo luận 7: Từ các phản ứng của các oxide và hydroxide: Na20, NaOH, Al2O3, Al(OH)3, SO2, H2SO4 với các dung dịch HCL, KOH hãy nhận xét tính acid, base của các oxide và hydroxide trên.
Thảo luận 8: Quan sát bảng 6.2, hãy liên hệ xu hướng biến đổi tính acid tính base của oxide và hydroxide tương ứng với tính kim loại, phi kim của các nguyên tố trong chu kì.
Luyện tập: Dựa vào xu hướng biến đổi tính acid-base của oxide và hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các hợp chất sau đây theo chiều giảm dần tính acid của chúng H2SiO3, HClO4, H2SO4, H3PO4.
Vận dụng: Aspartame là một chất làm ngọt nhân tạo, được sử dụng trong một số loại soda dành cho người ăn kiêng. Xác định vị trí của các nguyên tố tạo nên aspartame trong bảng tuần hoàn. Trong số các nguyên tố đó, nguyên tố nào có tính phi kim mạnh nhất?
BÀI TẬP
Câu 1: Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?
A. Si (Z=14) B. P (Z=15)
C. Ge (Z= 32) D. As (Z= 33)
Câu 2: Bốn nguyên tố A, E, M, Q cùng thuộc một nhóm A trong bảng tuần hoàn, có số hiệu nguyên tủ lần lượt là 9, 17, 35,53. Các nguyên tố này được sắp xếp theo chiều tính phi kim tăng dần theo dãy nào sau đây?
A. A, Q, E, M B. Q, M, E, Q
C. A, E, M, Q D. A, M, E, Q
Câu 3: Xét ba nguyên tố có cấu hình electron lần lượt là:
X. 1s22s22p63s1 Q: 1s22s22p63s2 Z: 1s22s22p63s23p1
Tính base tăng dần của các hydroxide là:
A. XOH < Q(OH)2 < Z (OH)3 B. Z(OH)3 < XOH < Q (OH)2
C. Z(OH)3 < Q(OH)2 < XOH D. XOH < Z(OH)2< Q(OH)2
Câu 4: Trong bảng tuần hoàn các nguyên tố hóa học hãy cho biết các nguyên tố nào có tính phi kim mạnh nhất. Giải thích.
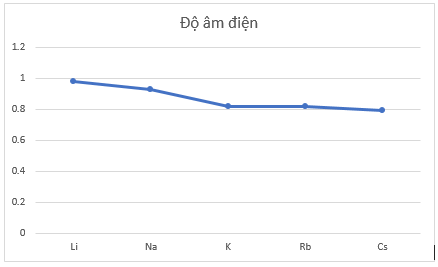
Câu 5: Cho bảng số liệu sau:
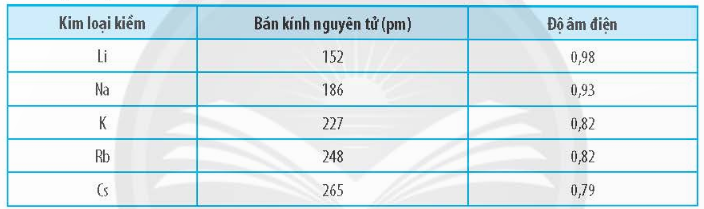
Hãy vẽ đồ thị hoặc biểu đồ với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng bằng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào? Giải thích.
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
- Không giốnh nhau.
- Có thể giải thích được.
1. BÁN KÍNH NGUYÊN TỬ
Thảo luận 1:
- Trong mỗi chu kì, có xu hướng giảm dần từ trái sang phải.
- Trong mỗi nhóm, có xu hướng tăng dần từ trên xuống dưới.
Thảo luận 2:
Điện tích hạt nhân.
Luyện tập:
O, N, Li, Na, K.
2. ĐỘ ÂM ĐIỆN
Thảo luận 3:
Theo chiều tăng dần của điện tích hạt nhân thì:
- Trong một chu kì, có xu hướng tăng dần do lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
- Trong một nhóm, có xu hướng giảm dần do bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Thảo luận 4:
Do là khí trơ mà khí trơ không nhường hay nhận electron.
Luyện tập:
K, Na, Mg, Al.
3. TÍNH KIM LOẠI, TÍNH PHI KIM
Thảo luận 5:
- Na → Na+ + 1e
Na nhường 1 electron để trở thành Na+
- F + 1e → F-
F nhận 1 electron để trở thành F-
Thảo luận 6:
a) Khả năng nhường electron hóa trị giảm dần và nhận electron hóa trị tăng dần.
b) Khả năng nhường electron hóa trị tăng dần và nhận electron hóa trị giảm dần.
Luyện tập:
Potassium, sodium, magnesium.
4. TÍNH ACID – BASE CỦA OXIDE VÀ HYDROXIDE
Thảo luận 7:
- Na2O: basic oxide
- Al2O3: oxide lưỡng tính
- SO3: acidic oxide
- NaOH: base
- Al(OH)3: hydroxide lưỡng tính
- H2SO4: acid
Thảo luận 8:
Theo chiều tăng dần của điện tích hạt nhân, tính base oxide của oxide và hydroxide tương ứng giảm dần, tính acid chúng tăng dần.
Luyện tập:
HClO4, H2SO4, H3PO4, H2SiO3.
Vận dụng:
- C: thuộc ô số 6, nhóm IVA, chu kì 2;
- H: thuộc ô số 1 nhóm IA, chu kì 1;
- N: thuộc ô số 7, nhóm VA, chu kì 2;
- O: thuộc ô số 8, nhóm VIA, chu kì 2;
O có tính phi kim mạnh nhất.
BÀI TẬP
Câu 1:
B.
Câu 2:
B.
Câu 3:
C.
Câu 4:
F vì theo chiều tăng dần của điện tích hạt nhân thì trong một chu kì tính phi kim tăng dần và trong một nhóm tính phi kim giảm dần. Mà F nằm ở cuối chu kì 2 và đầu nhóm VIIA.
Câu 5:
- Đồ thị:
|
|
- Nhận xét: trong một nhóm, theo chiều tăng dần của điện tích hạt nhân:
+ Bán kính nguyên tử tăng do số lớp electron tăng.
+ Độ âm điện giảm vì số lớp electron tăng dần từ trên xuống dưới nên lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 10 Chân trời sáng tạo, giải Hóa học 10 Chân trời sáng tạo trang 43, giải Hóa học 10 CTST trang 43

Bình luận