Slide bài giảng KHTN 8 cánh diều bài tập chủ đề 1
Slide điện tử bài tập chủ đề 1. Kiến thức bài học được hình ảnh hóa, sinh động hóa. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của học môn Khoa học tự nhiên 8 cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI TẬP (CHỦ ĐỀ 1)
Bài tập 1:
a) Hiện nay, gas thường được dùng làm nhiên liệu để đun nấu. Quá trình nào có sự biến đổi hoá học xảy ra trong các quá trình diễn ra dưới đây?
(1) Các khí (chủ yếu là butane và propane) được nén ở áp suất cao, hoá lỏng và tích trữ ở bình gas.
(2) Khi mở khoá bình gas, gas lỏng trong bình chuyển lại thành khí.
(3) Gas bắt lửa và cháy trong không khí chủ yếu tạo thành khí carbon dioxide và nước.
b) Gas thường rất dễ bắt cháy lại không mùi nên rất nguy hiểm nếu bị rò gỉ. Để dễ nhận biết, các nhà sản xuất thường bổ sung một khí có mùi vào bình gas. Theo em, cần làm gì nếu ngửi thấy có mùi gas trong nhà?
Trả lời rút gọn:
a) Quá trình 3 có sự biến đổi hoá học xảy ra.
b)
- Tắt ngay bếp và các nguồn lửa khác xung quanh khu vực đặt bình. Đóng van bình gas. Thông gió để phát tán làm giảm nồng độ hơi gas.
- Tìm chỗ rò bằng cách quét nước xà phòng rồi bịt chặt.
- Nếu không khắc phục được rò rỉ cần mang ngay bình ra nơi đất trống an toàn, thoáng gió, xa cống rãnh, xa nguồn lửa và khu dân cư. Liên hệ với các cơ quan chức năng để xử lí.
Bài tập 2. Đốt cháy hoàn toàn 9 gam kim loại magnesium trong oxygen thu được 15 gam magnesium oxide.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Viết phương trình bảo toàn khối lượng của các chất trong phản ứng.
c) Tính khối lượng oxygen đã phản ứng.
Trả lời rút gọn:
a) PTHH: 2Mg + O2 → 2MgO
b) mMg + ![]() = mMgO
= mMgO
c) ![]() = mMgO - mMg = 15 - 9 = 6 (gam)
= mMgO - mMg = 15 - 9 = 6 (gam)
Bài tập 3: Cho các sơ đồ phản ứng sau:
a) Na + O2 ® Na2O
b) P2O5 + H2O ® H3PO4
c) Fe(OH)3 ® Fe2O3 + H2O
d) Na2CO3 + CaCl2 ® CaCO3 ↓ + NaCl
Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử/ số phân tử của các chất trong mỗi phản ứng.
Trả lời rút gọn:
a)
- Bước 1: Viết sơ đồ phản ứng: Na + O2 ® Na2O
- Bước 2: So sánh số nguyên tử/nhóm nguyên tử của mỗi nguyên tố chất trước và sau phản ứng: Na + O2 ® Na2O
Số nguyên tử 1 2 2 1
- Bước 3: Cân bằng số nguyên tử/nhóm nguyên tử
Thêm hệ số 2 vào trước phân tử Na2O: Na + O2 ® 2Na2O
Thêm hệ số 4 vào trước nguyên tử Na: 4Na + O2 ® 2Na2O
- Bước 4: Kiểm tra và viết PTHH: 4Na + O2 ® 2Na2O
- Tỉ lệ hệ số nguyên tử Na : phân tử O2 : phân tử Na2O = 4 : 1 : 2
b)
- Bước 1: Viết sơ đồ phản ứng: P2O5 + H2O ® H3PO4
- Bước 2: So sánh số nguyên tử/nhóm nguyên tử của mỗi nguyên tố chất trước và sau phản ứng: P2O5 + H2O ® H3PO4
Số nguyên tử 2 5 2 1 3 1 4
- Bước 3: Cân bằng số nguyên tử/nhóm nguyên tử
Thêm hệ số 2 vào trước phân tử H3PO4: P2O5 + H2O ® 2H3PO4
Thêm hệ số 3 vào trước phân tử H2O: P2O5 + 3H2O ® 2H3PO4
- Bước 4: Kiểm tra và viết PTHH: P2O5 + 3H2O ® 2H3PO4
- Tỉ lệ hệ số phân tử P2O5 : phân tử H2O : phân tử H3PO4 = 1 : 3 : 2
c)
- Bước 1: Viết sơ đồ phản ứng: Fe(OH)3 ® Fe2O3 + H2O
- Bước 2: So sánh số nguyên tử/nhóm nguyên tử của mỗi nguyên tố/ chất trước và sau phản ứng: Fe(OH)3 ® Fe2O3 + H2O
Số nguyên tử 1 3 3 2 3 2 1
- Bước 3: Cân bằng số nguyên tử/nhóm nguyên tử
Thêm hệ số 2 vào trước phân tử 2Fe(OH)3: 2Fe(OH)3 ® Fe2O3 + H2O
Thêm hệ số 3 vào trước phân tử H2O: 2Fe(OH)3 ® Fe2O3 + 3H2O
- Bước 4: Kiểm tra và viết PTHH: 2Fe(OH)3 ® Fe2O3 + 3H2O
- Tỉ lệ phân tử Fe(OH)3 : phân tử Fe2O3 : phân tử H2O = 2 : 1 : 3
d)
- Bước 1: Viết sơ đồ phản ứng: CaCl2 + Na2CO3® CaCO3 ↓ + NaCl
- Bước 2: So sánh số nguyên tử/nhóm nguyên tử của mỗi nguyên tố chất trước và sau phản ứng: CaCl2 + Na2CO3 ® CaCO3 ↓ + NaCl
Số ngtử/nhóm ngtử 1 2 2 1 1 1 1 1
- Bước 3: Cân bằng số nguyên tử/nhóm nguyên tử
Thêm hệ số 2 vào trước phân tử NaCl
CaCl2 + Na2CO3 ® CaCO3 ↓ + 2NaCl
- Bước 4: Kiểm tra và viết PTHH: CaCl2 + Na2CO3® CaCO3 ↓ + 2NaCl
- Tỉ lệ hệ số phân tử CaCl2 : phân tử Na2CO3 : phân tử CaCO3 : phân tử NaCl = 1 : 1 : 1 : 2
Bài tập 4. Khí A có tỉ khối đối với H2 là 22.
a) Tính khối lượng mol của khí A.
b) Một phân tử khí A gồm 1 nguyên tử nguyên tố X liên kết với 2 nguyên tử oxygen. Xác định công thức hoá học của phân tử khí A.
Trả lời rút gọn:
a) MA = 22 x 2 = 44 g/mol
b) Gọi công thức của khí A là XO2
Do MA = 44 nên MX + 2 x 16 = 44 ® MX = 12. Vậy X là Carbon(C)
Công thức hoá học của phân tử khí A là CO2.
Bài tập 5. Đồ thị hình 1 biểu thị sự phụ thuộc của độ tan (S) của các chất (a), (b), (c) và (d) theo nhiệt độ (to).
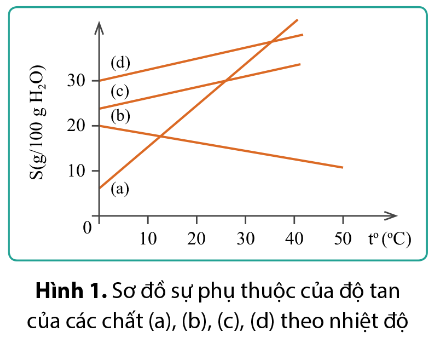
a) Các chất có độ tan tăng theo nhiệt độ là
A. (a), (b), (c). B. (b), (c), (d). C. (a), (c), (d). D.(a), (b), (d).
b) Ở 30oC, chất có độ tan lớn nhất là?
A. (a). B. (b). C. (c). D. (d).
c) Chất có độ tan giảm khi nhiệt độ tăng là
A. (d). B. (c). C. (b). D. (a).
Trả lời rút gọn:
a) C.
b) D.
c) C.
Bài tập 6. Viết công thức hóa học của hai chất khí nhẹ hơn không khí, hai chất khí nặng hơn không khí.
Trả lời rút gọn:
CTHH chất khí nhẹ hơn không khí: H2, N2.
CTHH chất khí nặng hơn không khí: CO2, SO2.
Bài tập 7. Có hai ống nghiệm, mỗi ống đều chứa một mẩu đá vôi (thành phần chính là CaCO3) có kích thước tương tự nhau. Sau đó cho vào mỗi ống khoảng 5 ml dung dịch HCl có nồng độ nồng độ lần lượt là 5% và 15%.
a) Viết phương trình hóa học của phản ứng biết rằng sản phẩm tạo thành gồm CaCl2, CO2 và H2O.
b) Phản ứng hóa học ở ống nghiệm nào sẽ xảy ra nhanh hơn. Giải thích.
Trả lời rút gọn:
a) CaCO3 + 2HCl ® H2O + CO2↑ + CaCl2.
b) Ống nghiệm chứa dung dịch HCl 15% phản ứng hóa học sẽ xảy ra nhanh hơn. Vì nồng độ tăng thì tốc độ phản ứng tăng, khi nồng độ các chất tham gia phản ứng tăng thì số phân tử hoạt động có trong một đơn vị thể tích tăng dẫn đến số va chạm có hiệu quả tăng ® tốc độ phản ứng tăng.
