Trắc nghiệm Hoá học 10 Cánh diều Bài 15 Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài trắc nghiệm có đáp án. Câu hỏi và bài tập trắc nghiệm Hoá học 10 Bài 15 Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học - sách Cánh diều . Học sinh luyện tập bằng cách chọn đáp án của mình trong từng câu hỏi. Dưới cùng của bài trắc nghiệm, có phần xem kết quả để biết bài làm của mình. Kéo xuống dưới để bắt đầu.
Câu 1: Hydrogen phản ứng với chlorine để tạo thành hydrogen chloride theo phương trình
H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng có giá trị là
(Biết năng lượng liên kết E(H-H) = 436 kJ/mol, E(Cl-Cl) = 243 kJ/mol, E(H-Cl) = 432kJ/mol).
- A. + 185kJ/mol.
B. −185 kJ/mol.
- C. −92,5 kJ/mol.
- D. + 92,5kJ/mol.
Câu 2: Propane (C3H8) là một hydrocarbon phổ biến thường được dùng làm nhiên liệu do quá trình cháy giải phóng lượng nhiệt lớn. Khi đốt cháy 1 mol propane thì giải phóng −2219,2 kJ nhiệt lượng. Nhiệt tạo thành chuẩn của propane là (biết nhiệt tạo thành chuẩn của H2O(l) = −285,8 kJ/ mol; CO2(g) = −393,5 kJ/mol).
- A. +212,2 kJ.
- B. +1539,9 kJ.
C. -104,5 kJ.
- D. –1539,9 kJ.
Câu 3: Hydrogen bromide bị phân hủy tạo thành hydrogen và bromine theo phương trình
2HBr(g) → H2(g) + Br2(g). Năng lượng liên kết của các liên kết được cho trong bảng sau. Biến thiên entahlpy của phản ứng là
Loại liên kết | Năng lượng liên kết (kJ/mol) |
Br-Br | +193 |
H-Br | +366 |
H-H | +436 |
- A. +263 kJ/mol.
B. +103 kJ/mol.
- C. -263 kJ/mol.
- D. -103 kJ/mol.
Câu 4: Khi đốt cháy glucose (C6H12O6) thấy giải phóng -2816 kJ/mol nhiệt lượng ở 25oC. Enthalpy tạo thành chuẩn của C6H12O6 nhận giá trị là (biết enthalpy tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol và - 285,9 kJ/mol).
- A. +1260,4 kJ.
- B. -2136,6 kJ.
C. -1260,4 kJ.
- D. +2136,6 kJ.
Câu 5: Ammonia được tạo ra bằng cách cho nitrogen phản ứng với hydrogen với sự có mặt của chất xúc tác là iron. Phương trình phản ứng tạo ammonia diễn ra như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biến thiên enthalpy chuẩn của phản ứng tính theo năng lượng liên kết nhận giá trị nào dưới đây?Biết năng lượng liên kết của một số loại liên kết được cho trong bảng sau.
Liên kết | Năng lượng liên kết (kJ/mol) |
N≡N | 945 |
N-H | 390 |
H-H | 436 |
- A. –959kJ /mol.
- B. –1083kJ/mol.
- C. –4593kJ/mol.
D. –87kJ/mol.
Câu 6: Tiến hành đốt cháy 1 mol benzene ở điều kiện chuẩn, phản ứng sinh ra CO2(g), H2O(l) đồng thời giải phóng 3267 kJ nhiệt lượng. Enthalpy tạo thành chuẩn của benzene nhận giá trị là(biết enthalpy tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol; -285,83 kJ/mol).
- A. -48,51 kJ/mol.
- B. +24,5 kJ/mol.
C. +48,51 kJ/mol.
- D. -24,5 kJ/mol.
Câu 7: NO2(g) được hình thành từ sự kết hợp của NO(g) và O2(g) theo phản ứng sau:
2NO(g) + O2(g) → 2NO2(g)
Biến thiên enthalpy chuẩn của phản ứng có giá trị (cho enthalpy tạo thành chuẩn củaO2(g): 0 kJ/mol; NO(g): 90,25 kJ/mol; NO2(g): 33,18 kJ/mol).
- A. +57,07 kJ.
B. –114,14 kJ.
- C. –57,07 kJ.
- D. +114,14 kJ.
Câu 8: Biến thiên enthalpy của phản ứng 2H2(k) + O2(k) → 2H2O(k) tính theo năng lượng liên kết có biểu thức tính là (nếu coi Eb(H-H) = x, Eb(O=O) = y, Eb (O - H) = z)
- A. 2z - 2x – y.
- B. 4z - 2x – y.
C. 2x + y - 4z.
- D. 2x + y - 2z.
Câu 9: Đốt cháy 3,6 gam butanol (C4H9OH) thấy có 134 kJ nhiệt được giải phóng. Biến thiên enthalpy của quá trình đốt cháy 1 mol butanol là
- A. 2754,44 kJ/mol.
- B. -134 kJ/mol.
C. -2754,44 kJ/mol.
- D. -268 kJ/mol.
Câu 10: Hydrogen peroxide, H2O2 được sử dụng để cung cấp lực đẩy cho tên lửa do dễ dàng bị phân hủy theo phương trình: 2H2O2(l)→ 2H2O(g) + O2(g). Lượng nhiệt được tạo ra khi phân hủy chính xác 1 mol H2O2 ở điều kiện chuẩn là (biết nhiệt tạo thành chuẩn của H2O(g) = −241,8 kJ/ mol; H2O2(l) = −187,8 kJ/mol).
- A. -108 kJ.
B. –54 kJ.
- C. +54 kJ.
- D. +108 kJ.
Câu 11: Khi tạo ra 1 mol HCl từ các đơn chất bền có giải phóng ra một lượng nhiệt là 91,98 kJ/mol. Nếu phân huỷ 365 gam khí HCl thành các đơn chất thì lượng nhiệt kèm theo quá trình đó là bao nhiêu ?
- A. - 459,9 kJ.
- B. - 919,8 kJ.
- C. + 459,9 kJ.
D. + 919,8 kJ.
Câu 12: Thực vật sử dụng quá trình quang hợp để chuyển đổi năng lượng ánh sáng từ mặt trời thành năng lượng hóa học. Trong quá trình quang hợp xảy ra phản ứng giữa khí carbonic và nước theo phương trình hóa học
6CO2(g) + 6H2O(l)→ C6H12O6(aq) + 6O2(g)
Biến thiên enthalpy chuẩn của phản ứng có giá trị là (cho enthalpy tạo thành chuẩn của CO2(g) = -393,5 kJ/mol; H2O(l) = -285,8 kJ/mol; C6H12O6(aq) = -1271 kJ/mol).
- A. +591,7 kJ.
- B. –591,7 kJ.
- C. –2804,8 kJ.
D. +2804,8 kJ.
Câu 13: Phản ứng đốt cháy methane xảy ra như sau:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Giá trị biến thiên enthalpy phản ứng tính theo enthalpy tạo thành có giá trị là
(biết enthalpy tạo thành chuẩn của các chất CH4(g)=-74,8 kJ/mol; CO2(g)= -393,5 kJ/mol; H2O(l)= -285,8 kJ/mol).
A. - 604,5 kJ.
- B. - 997,7 kJ.
- C. - 890,3 kJ.
- D. + 890,3 kJ.
Câu 14: Nhiệt lượng tỏa ra từ quá trình đốt cháy 6,44 gam sulfur trong oxygen theo phương trình: 2S(s) + 3O2(g) → 2SO3(l) $\Delta _{r}H_{298}^{o}$= -791,4 kJ có giá trị là
- A. +79,63 kJ.
- B. - 395,7 kJ.
C. -79,63 kJ.
- D. +395,7 kJ.
Câu 15: Nitrogen trifluoride (NF3) là nguyên liệu được sử dụng trong việc sản xuất pin mặt trời. Phương trình hình thành nitrogen trifluoride được biểu diễn như sau:
N2(g) + 3F2(g) →2NF3(g)
Sử dụng bảng năng lượng liên kết cho biết biến thiên enthalpy chuẩn của phản ứng nhận giá trị nào dưới đây?
Loại liên kết | Năng lượng liên kết (kJ/mol) |
N≡N | +950 |
F-F | +150 |
N-F | +280 |
- A. +3080 kJ/mol.
B. -280 kJ/mol.
- C. +280 kJ/mol.
- D. -560 kJ/mol
Câu 16: Hydrazine (N2H4) bị phân hủy như sau:
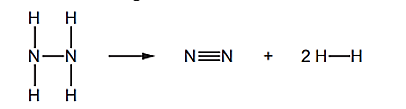
Biến thiên enthalpy chuẩn của phản ứng được xác định là –99 kJ/mol.
Năng lượng liên kết của liên kết N – N là bao nhiêu? Biết năng lượng liên kết của một số loại liên kết được cho trong bảng sau.
Liên kết | Năng lượng liên kết (kJ/mol) |
N≡N | 946 |
N-H | 389 |
H-H | 436 |
- A. 895 kJ/mol.
- B. 315 kJ/mol.
- C. 348 kJ/mol.
D. 163 kJ/mol.
Câu 1: Phát biểu nào sau đây không đúng?
- A. Phản ứng tỏa nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ chất phản ứng ra môi trường.
- B. Phản ứng thu nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ môi trường vào chất phản ứng.
C. Phản ứng phân hủy là phản ứng tỏa nhiệt.
- D. Phản ứng phân hủy là phản ứng thu nhiệt.
Câu 17: Nhiệt tạo thành chuẩn của khí Nitrogen trong phản ứng hóa học là
A. 0 kJ/mol.
- B. 1 kJ/mol.
- C. 273 kJ/mol.
- D. 298 kJ/mol.
Câu 18: Biến thiên enthalpy của các phản ứng phụ thuộc vào yếu tố nào trong các yếu tố sau:
(1) Điều kiện xảy ra phản ứng.
(2) Trạng thái vật lý của các chất.
(3) Số lượng chất tham gia.
(4) Số lượng chất sản phẩm.
A. (1) và (2).
- B. (3) và (4).
- C. (1) và (3).
- D. (2) và (4).
Câu 19: Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo nhiệt tạo thành là?
A. $\Delta {_{r}}H_{298}^{o}$=∑$\Delta {_{f}}H_{298}^{o}$(sp)−∑$\Delta {_{f}}H_{298}^{o}$(cđ).
- B. $\Delta {_{r}}H_{298}^{o}$=∑$\Delta {_{f}}H_{298}^{o}$(cđ)−2.∑Δ$\Delta {_{f}}H_{298}^{o}$(sp)
- C. $\Delta {_{r}}H_{298}^{o}$=3.∑Eb(sp)−∑Eb(cđ)
D. $\Delta {_{r}}H_{298}^{o}$=∑Eb(cđ)−2∑Eb(sp)
Câu 20: Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo năng lượng liên kết (các chất đều ở thể khí) là?
A. $\Delta {_{r}}H_{298}^{o}$=∑$\Delta {_{f}}H_{298}^{o}$(sp)−∑$\Delta {_{f}}H_{298}^{o}$(cđ).
- B. $\Delta {_{r}}H_{298}^{o}$=∑$\Delta {_{f}}H_{298}^{o}$(cđ)−2.∑Δ$\Delta {_{f}}H_{298}^{o}$(sp)
- C. $\Delta {_{r}}H_{298}^{o}$=3.∑Eb(sp)−∑Eb(cđ)
D. $\Delta {_{r}}H_{298}^{o}$=∑Eb(cđ)−∑Eb(sp)

Bình luận