Siêu nhanh giải bài 15 Hóa học 12 Kết nối tri thức
Giải siêu nhanh bài 15 Hóa học 12 Kết nối tri thức. Giải siêu nhanh Hóa học 12 Kết nối tri thức. Những phần nào có thể rút gọn, lược bỏ và tóm gọn. Đều được áp dụng vào bài giải này. Thêm cách giải mới để học sinh lựa chọn. Để tìm ra phong cách học Hóa học 12 Kết nối tri thức phù hợp với mình.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 15. THẾ ĐIỆN CỰC VÀ NGUỒN ĐIỆN HÓA HỌC
MỞ ĐẦU
Pin điện hóa là nguồn năng lượng được sử dụng phổ biến trong nhiều thiết bị như đèn pin, điện thoại, laptop, máy tính cầm tay, đồng hồ, xe đạp điện, xe máy điện, ô tô, máy bay không người lái,... Pin điện hóa có cấu tạo như thế nào? Phản ứng oxi hóa – khử đóng vai trò gì trong hoạt động của pin điện hóa? Làm thế nào để lắp ráp được một số pin điện hóa đơn giản?
Giải rút gọn:
- Pin điện hóa gồm hai điện cực nối với nhau qua mối nối.
- Đóng vai trò tạo ra một dòng electron từ anode đến cathode qua một dây nối, tạo nên dòng điện.
- Cách lắp ráp được một số pin điện hóa đơn giản:
+ Chọn hai điện cực của hai thanh kim loại khác nhau, ví dụ như thanh kẽm và thanh đồng.
+ Cắm hai thanh kim loại vào quả chanh.
+ Nối cực âm của vôn kế với thanh kẽm và cực dương của vôn kế với thanh đồng.
I. CẶP OXI HÓA - KHỬ
Hoạt động nghiên cứu: Nhúng một thanh kẽm vào cốc đựng dung dịch copper(II) sulfate (Hình 15.2a), sau một thời gian nhấc thanh kẽm ra thì thấy xuất hiện một lớp đồng màu đỏ bám vào thanh kẽm (Hình 15.2b).

1. Viết phương trình hóa học dạng ion rút gọn của phản ứng oxi hóa – khử xảy ra trong thí nghiệm.
2. Viết quá trình oxi hóa nguyên tử Zn và quá trình khử Cu2+. Chỉ ra dạng oxi hóa và dạng khử trong mỗi quá trình.
3. Biểu diễn dạng oxi hóa và dạng khử của mỗi nguyên tố trên như sau: dạng oxi hóa/dạng khử.
Giải rút gọn:
1. Phương trình hóa học dạng ion rút gọn: Cu2+ + Zn ![]() Zn2+ + Cu.
Zn2+ + Cu.
2. - Quá trình oxi hóa nguyên tử Zn: Zn ![]() Zn2+ + 2e
Zn2+ + 2e
Dạng oxi hóa: Zn2+, dạng khử: Zn.
- Quá trình khử Cu2+: Cu2+ + 2e ![]() Cu
Cu
Dạng oxi hóa: Cu2+, dạng khử: Cu.
3. Zn2+/Zn, Cu2+/Cu.
Câu hỏi 1: Viết bán phản ứng hoặc cặp oxi hóa – khử còn thiếu trong bảng dưới đây vào vở:

Giải rút gọn:
Bán phản ứng | Cặp oxi hóa – khử | Bán phản ứng | Cặp oxi hóa – khử |
Na+ + 1e | Na+/Na | 2H+ + 2e | 2H+/H2 |
Al3+ + 3e | Al3+/Al | Ag+ + 1e | Ag+/Ag |
Fe2+ + 2e | Fe2+/Fe | Au3+ + 3e | Au3+/Au |
Câu hỏi 2: Cho đinh sắt (iron) tác dụng với dung dịch hydrochloric acid, thu được muối iron(II) chloride và khí hydrogen.
a) Viết phương trình hóa học của phản ứng ở dạng ion thu gọn.
b) Xác định các cặp oxi hóa – khử trong các phản ứng trên.
Giải rút gọn:
a) Fe + 2H+ ![]() Fe2+ + H2
Fe2+ + H2
b) 2H+/H2, Fe2+/Fe.
II. THẾ ĐIỆN CỰC CHUẨN
Câu hỏi 3: Cho các cặp oxi hóa – khử sau: Na+/Na, Mg2+/Mg, Zn2+/Zn, Al3+/Al, Fe2+/Fe, Ag+/Ag, 2H+/H2, Cu2+/Cu.
Dựa vào Bảng 15.1 sắp xếp các cặp oxi hóa – khử trên theo chiều giảm dần tính khử của dạng khử.
Giải rút gọn:
Na > Mg > Al > Zn > Fe > H2 > Cu > Ag.
Hoạt động nghiên cứu: Nghiên cứu về chiều phản ứng giữa các cặp oxi hóa – khử
Xét hai phương trình oxi hóa – khử sau:
Zn + Cu2+ ![]() Zn2+ + Cu (1)
Zn2+ + Cu (1)
Cu + 2Ag+ ![]() Cu2+ + 2Ag (2)
Cu2+ + 2Ag (2)
1. Dựa vào Bảng 15.1, so sánh thế điện cực chuẩn của các cặp oxi hóa – khử: Zn2+/Zn với Cu2+/Cu, Cu2+/Cu với Ag+/Ag.
2. Chỉ ra chất khử mạnh hơn và chất oxi hóa mạnh hơn trong mỗi phản ứng.
3. Dựa vào giá trị thế điện cực chuẩn, rút ra nhận xét chung về chiều phản ứng giữa các cặp oxi hóa – khử ở trên.
Giải rút gọn:
1. - ![]()
- ![]()
2. - Ở (1) tính khử của Zn mạnh hơn Cu, tính oxi hóa của Zn2+ yếu hơn Cu2+.
- Ở (2) tính khử của Cu mạnh hơn Ag, tính oxi hóa của Cu2+ yếu hơn Ag+.
3. Chiều phản ứng giữa hai cặp oxi hóa – khử có thể dự đoán được từ việc sao sánh giá trị thế điện cực chuẩn.
Câu hỏi 4: Ở điều kiện chuẩn, kim loại M có thể tác dụng với dung dịch acid (H+), với nước khi giá trị thế điện cực chuẩn của cặp oxi hóa – khử kim loại Mn+/ M thỏa mãn điều kiện nào?
Giải rút gọn:
Điều kiện: giá trị thế điện cực chuẩn của cặp Mn+/ M bé hơn H+/H.
Câu hỏi 5: Dựa vào giá trị thế điện cực chuẩn ở Bảng 15.1, hãy viết phương trình hóa học của phản ứng xảy ra giữa các cặp oxi hóa – khử sau:
a) Ni2+/Ni và 2H+/H2.
b) Fe2+/Fe và Cu2+/Cu.
c) Zn2+/Zn và Au3+/Au.
Giải rút gọn:
a) Ni + H+ ![]() Ni2+ + H2.
Ni2+ + H2.
b) Fe + Cu2+ ![]() Fe2+ + Cu.
Fe2+ + Cu.
c) Zn + Au3+ ![]() Zn2+ + Au.
Zn2+ + Au.
III. PIN ĐIỆN HÓA
Hoạt động nghiên cứu: Phản ứng oxi hóa – khử luôn kèm theo sự chuyển electron từ chất khử sang chất ion hóa. Nếu các quá trình oxi hóa, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hóa qua dây dẫn thì năng lượng của phản ứng hóa học sẽ chuyển thành năng lượng điện.
Xét phản ứng oxi hóa – khử:

Phản ứng hóa học trên xảy ra trong hai thí nghiệm sau:
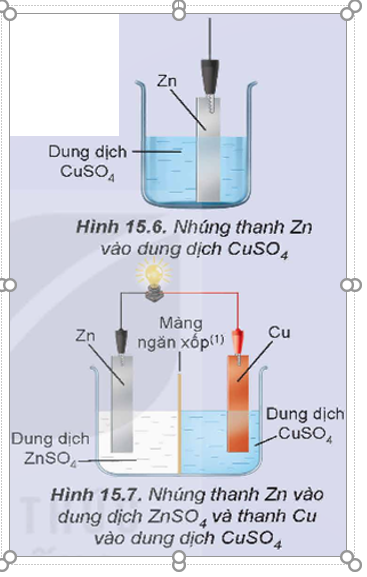
Thí nghiệm 1: Cho Zn tiếp xúc trực tiếp với ion Cu2+ bằng cách nhúng thanh Zn vào dung dịch CuSO4 (Hình 15.6), thấy xuất hiện kim loại đồng màu đỏ bám trên bề mặt thanh kẽm.
Thí nghiệm 2: Lắp hệ điện hóa gồm hai điện cực Zn2+/Zn và Cu2+/Cu như Hình 15.7, thấy bóng đèn sáng.
Thực hiện các yêu cầu sau:
1. Viết quá trình oxi hóa, quá trình khử trong mỗi thí nghiệm.
2. Trong thí nghiệm nào thì quá trình oxi hóa và quá trình khử cùng xảy ra trên bề mặt của một thanh kim loại?
3. Tại sao trong thí nghiệm 2 bóng đèn lại sáng?
Giải rút gọn:
1.
- Thí nghiệm 1:
+ Quá trình khử: Zn ![]() Zn2+ + 2e.
Zn2+ + 2e.
+ Quá trình oxi hóa: Cu2+ + 2e ![]() Cu.
Cu.
- Thí nghiệm 2:
+ Quá trình khử: Zn ![]() Zn2+ + 2e.
Zn2+ + 2e.
+ Quá trình oxi hóa: Cu2+ + 2e ![]() Cu.
Cu.
2. Trong cả hai thí nghiệm.
3. Vì có dòng điện chạy qua.
Câu hỏi 6: Một pin Galvani được thiết lập ở điều kiện chuẩn theo sơ đồ Hình 15.10. Dựa vào giá trị thế điện cực chuẩn ở Bảng 15.1:
a) Xác định anode, cathode và viết các quá trình xảy ra ở anode, cathode. Viết phương trình hóa học của phản ứng xảy ra trong pin.
b) Tính sức điện động chuẩn của pin và so sánh với giá trị hiển thị trên vôn kế.
c) Xác định chiều của dòng electron chạy qua dây dẫn.
Giải rút gọn:
a) - Anode là Cu và cathode là Ag.
- Quá trình ở anode: Cu ![]() Cu2+ + 2e
Cu2+ + 2e
- Quá trình ở cathode: Ag+ + 1e ![]() Ag
Ag
- PTHH phản ứng xảy ra trong pin: Cu + Ag+ ![]() Cu2+ + Ag
Cu2+ + Ag
b) Ta có: ![]()
- Sức điện động chuẩn của pin là: ![]() V.
V.
- Ta thấy giá trị bằng với giá trị hiển thị trên vôn kế.
c) Dòng electron chạy qua dây dẫn là từ anode về cathode.
IV. MỘT SỐ LOẠI PIN KHÁC
Câu hỏi 7: Phân loại các loại pin sử dụng trong gia đình và đề xuất cách thu gom, xử lí khi hết hạn sử dụng để bảo vệ môi trường.
Giải rút gọn:
- Phân loại các pin được sử dụng trong gia đình:
+ Acquy.
+ Pin Mặt Trời.
- Cách thu gom, xử lí khi hết hạn sử dụng để bảo vệ môi trường:
+ Bảo quản, phân loại pin đã qua sử dụng trước khi đến điểm thu gom.
+ Kéo dài tuổi thọ của pin.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải Hóa học 12 Kết nối tri thức bài 15, Giải bài 15 Hóa học 12 Kết nối tri thức, Siêu nhanh giải bài 15 Hóa học 12 Kết nối tri thức
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận