5 phút giải Hóa học 11 Cánh diều trang 44
5 phút giải Hóa học 11 Cánh diều trang 44. Giúp học sinh nhanh chóng, mất ít thời gian để giải bài. Tiêu chi bài giải: nhanh, ngắn, súc tích, đủ ý. Nhằm tạo ra bài giải tốt nhất. 5 phút giải bài, bằng ngày dài học tập.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 7. SULFURIC ACID VÀ MUỐI SULFATE
PHẦN I. HỆ THỐNG CÂU HỎI, BÀI TẬP TRONG SGK
Bài 1: Nhãn dán trên chai đựng dung dịch sulfuric acid...
I. SULFURIC ACID
Bài 1: Hãy viết công thức Lewis của phân tử H2SO4.
Bài 2: Tính oxi hoá của dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc...
Bài 3: Tính háo nước và tính oxi hoá của dung dịch sulfuric acid đặc...
Bài 4: Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric...
Bài 5: Số oxi hoá lớn nhất của sulfur trong các hợp chất là...
Bài 6: Dự đoán hiện tượng xảy ra khi cho vài giọt dung dịch sulfuric...
Bài 7: Phòng thí nghiệm có một lọ đựng dung dịch sulfuric acid...
Bài 8: "Nhờ có chất xúc tác nên phản ứng giữa SO2 và O2...
Bài 9: Quá trình sản xuất sulfuric acid có thể ảnh hưởng đến môi...
II. MUỐI SULFATE
Bài 1: Hai chất phụ gia thực phẩm đều màu trắng là bột thạch cao nung...
Bài 2: Trình bày cách sử dụng dung dịch barium hydroxide...
BÀI TẬP CUỐI SGK
Bài 1: a) Tính thể tích dung dịch H2SO4 98%...
Bài 2: Các ao, hồ, suối, sông quanh miệng núi lửa thường có môi trường acid...
Bài 3: Dựa vào tính chất nào để phân biệt nhanh muối...
Bài 4: Viết phương trình hoá học của các phản ứng theo...
PHẦN II. 5 PHÚT TRẢ LỜI CÂU HỎI, BÀI TẬP TRONG SGK
Bài 1:
Ý nghĩa: cảnh báo sự nguy hiểm của sulfuric acid gây bỏng da khi rơi vào da. Nguyên nhân: sulfuric acid gây ăn mòn, bỏng da.
I. SULFURIC ACID
Bài 1:
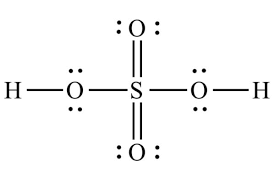
Bài 2:
Hiện tượng:(1): Không có hiện tượng xảy ra. (2): Mảnh đồng tan dần, dung dịch màu xanh và sủi bọt khí, mùi hắc.
PTHH: Cu + 2H2SO4 → CuSO4+ SO2↑ + 2H2O
Chất khử: Cu; Chất oxi hóa: H2SO4
Bài 3:
Hiện tượng: đường hoặc tinh bột hóa đen, sau đó khối rắn tăng thể tích rất nhanh và thoát khí mùi hắc
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
(C6H10O5)n + H2SO4 đặc → 6nC + H2SO4.5nH2O
C + 2H2SO4 → 12CO2↑ + 2SO2↑ + 2H2O
Bài 4:
H2SO4 + Zn → ZnSO4 + H2
H2SO4 + ZnO → ZnSO4 + H2O
H2SO4 + Ba(OH)2 → BaSO4 + 2H2O
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Bài 5:
Số oxh: +6. H2SO4 không thể hiện tính khử.
Bài 6:
Hiện tượng: tinh bột (hạt cơm) nhanh chóng hóa đen, khí mùi hắc
(C6H10O5)n + H2SO4 đặc → 6nC + H2SO4.5nH2O
C + 2H2SO4 → 12CO2↑ + 2SO2↑ + 2H2O
Bài 7:
Sử dụng nước vôi Ca(OH)2 để kết tủa ion SO42−
H2SO4 + Ca(OH)2 → CaSO4 + H2O
Bài 8:
Sai.
Vì chất xúc tác giúp hệ đạt nhanh tới trạng thái cân bằng bằng cách tăng tốc độ phản ứng thuận và phản ứng nghịch.
Bài 9:
Nguyên nhân: quá trình đốt cháy khoáng vật pyrite tạo sulfur dioxide.
Biện pháp:
- Dùng nhiên liệu thân thiện môi trường như ethanol, hydrogen,... kết hợp với khai thác các nguồn năng lượng tái tạo.
- Xử lí khí thải.
- Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm.
II. MUỐI SULFATE
Bài 1:
- Bột tan trong HCl tạo khí: baking soda (NaHCO3).
- Bột không tan HCl: Thạch cao nung.
PTHH: NaHCO3 + HCl → NaCl + CO2 + H2O
Bài 2:
- Xuất hiện kết tủa và khí có mùi khai => (NH4)2SO4
- Xuất hiện khí có mùi khai => NH4Cl
- Không hiện tượng => NaNO3
PTHH:
Ba(OH)2 + (NH4)2SO4 → BaSO4 + 2NH3 + 2H2O
Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH3 + 2H2O
BÀI TẬP CUỐI SGK
Bài 1:
a) 1,36 ml
b) 10 ml
Bài 2:
Vì trong không khí sulfuric dioxide tác dụng với oxygen tạo sulfur trioxide. Khi gặp nước, sulfur trioxide tan tạo dung dịch sulfuric acid.
SO2 + 1/2O2 → SO3
SO3 + H2O → H2SO4
Bài 3:
Dựa vào tính hút nước.
Bài 4:
FeS2 + O2 → Fe2O3 + SO2
SO2 + 1/2O2 → SO3
SO3 + H2O → H2SO4
NH3 + H2SO4 → (NH4)2SO4
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
giải 5 phút Hóa học 11 Cánh diều, giải Hóa học 11 Cánh diều trang 44, giải Hóa học 11 CD trang 44
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận